Esquema de pasos para realizar la medición de índices de reposo y de FFR
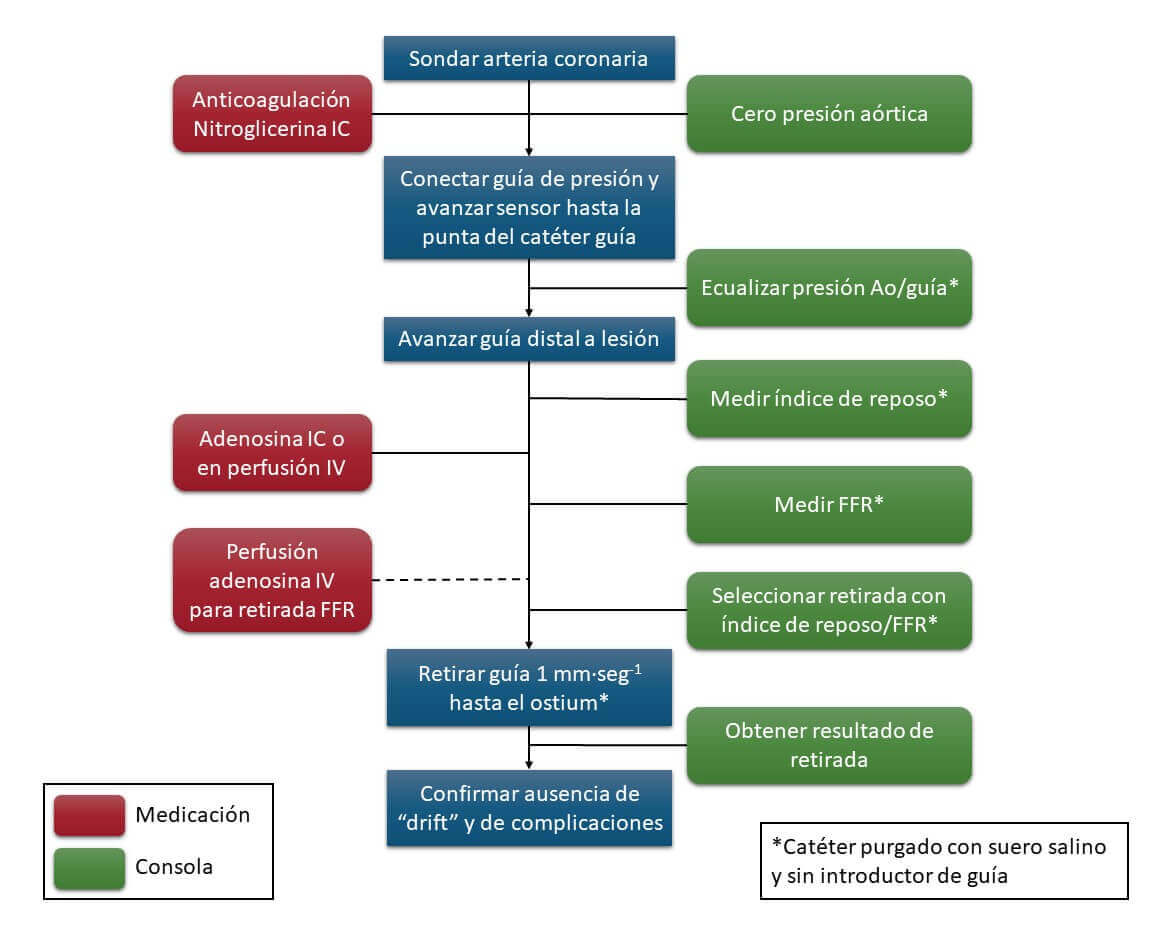
(1) Sondar la arteria a estudiar con catéter guía habitual, asegurarse de que no cae la presión aórtica con el sondaje.
(2) Anticoagulación con heparina sódica (70-100 UI/kg).
(3) Administrar 100-300 µg de nitroglicerina intracoronaria.
(4) Realizar el cero de la presión aórtica en el polígrafo de la sala y asegurar que todas las conexiones estén bien ajustadas.
(5) Conectar y ecualizar la guía de presión a presión atmosférica.
(6) Avanzar la guía hasta que el sensor esté localizado al mismo nivel que la punta del catéter guía.
(7) Retirar introductor de guía y lavar el catéter guía con suero salino.
(8) Ecualizar/normalizar la presión de la guía con la del catéter en la consola, asegurando que ambas ondas de presión son iguales.
(9) Avanzar la guía hasta unos 2 a 3 centímetros distal a la lesión o zona a estudiar.
(10) Retirar nuevamente el introductor de guía (si fue necesario reintroducirlo) y lavar el catéter guía con suero salino.
(11) En caso de los índices de reposo, seleccionarlo en la consola y realizar la medición en este momento.
(12) Para medir el FFR, cambiar el modo de la consola a FFR, administrar la adenosina intracoronaria (200 µg para la coronaria izquierda, 100 µg para la coronaria derecha) o intravenosa (140 µg/kg/min). Al usar adenosina intracoronaria considerar el FFR la menor relación Pd/Pa (cociente de presión coronaria distal/aórtica) obtenida después de la inducción de la hiperemia (usualmente 15 a 20 segundos). En el caso de adenosina intravenosa esperar a obtener una hiperemia estable durante unos 90 a 180 segundos de infusión, de igual forma obtener la menor relación Pd/Pa.
(13) Para estudiar la distribución de las estenosis a lo largo del vaso, se pueden utilizar índices en reposo que permiten realizar retiradas como el iFR y el RFR, o también se puede realizar con FFR si se utiliza una infusión continua de adenosina. Se realiza una retirada lenta de la guía manteniendo la hiperemia observando simultáneamente la ubicación de la guía con fluoroscopia. En el caso de lesiones difusas, se observará una recuperación progresiva de la presión a lo largo de todo el vaso. En el caso de estenosis focales se podrá observar un incremento brusco de la presión proximal a la lesión. Se puede confirmar el lugar exacto de la lesión moviendo la guía hacia adelante y atrás en la zona de interés.
(14) Confirmar ausencia de “drift” con el transductor de la guía en la posición inicial. Si el drift de presión es mayor a 2 a 5 mmHg se recomienda volver a normalizar y repetir la medición.
(15) Retirar la guía intracoronaria y realizar una angiografía para comprobar la ausencia de complicaciones.
Problemas, causas y soluciones
La tabla 3 muestra algunos de los principales problemas que se pueden encontrar al realizar un estudio con guía de presión, sus causas y soluciones.
Existen detalles del procedimiento que hay que tener en cuenta para obtener una medición lo más fiable posible. Hay que asegurar que todas las conexiones estén bien realizadas y que se retira el introductor de guía al realizar mediciones, ya que puede ocasionar que la presión aórtica esté falsamente disminuida. Se debe lavar el catéter guía con suero salino para evitar que la presión aórtica se vea amortiguada. Además, de asegurar que el momento de la adquisición no existan variaciones relacionadas con la respiración, tos o arritmias.
La amortiguación de la presión aórtica por el catéter guía puede ocurrir con catéteres de mayor diámetro (7-8F), en presencia de lesiones ostiales o con vasos epicárdicos de pequeño calibre. En esos casos se recomienda que el catéter guía está fuera de la coronaria para obtener una medición real de la presión aórtica, tanto en el momento de la ecualización de las presiones como en el de la medición.
Los catéteres con agujeros laterales pueden ocasionar un gradiente de presión entre la aorta y el catéter, que puede no objetivarse hasta que se induce la hiperemia. En caso sea necesario utilizarlo, es indispensable desenganchar el catéter de la coronaria al realizar las mediciones. Cuando se utilicen estos catéteres no se debe administrar adenosina IC dado que parte de la dosis se iría directamente a la aorta.
Se puede sospechar la presencia de drift cuando, aunque existan diferencias de presión entre la medición proximal y distal, la forma de la onda distal mantiene su hendidura dícrota, ya que las estenosis significativas actúan como un filtro de alta frecuencia, dificultando la transmisión de las señales responsables de la presencia esta hendidura. La presencia de drift es más frecuente después de desconectar/reconectar la guía, especialmente después de la angioplastia, o tras su uso prolongado; las guías con tecnología de fibra óptica y los catéteres tienen menos drift que las que utilizan un sistema piezoeléctrico.
Espasmo y pseudoestenosis: el paso de cualquier guía intracoronaria puede generar espasmo coronario, por lo que es importante la administración intracoronaria de nitroglicerina. Incluso en pacientes con tensiones bajas, que una dosis baja de nitroglicerina (50-100 µg) se tolera adecuadamente. El paso de la guía puede rectificar arterias tortuosas, generando el conocido efecto acordeón, que ocasionaría una medición falsamente alterada, por lo que resulta importante realizar una angiografía con la guía pasada en arterias tortuosas y compararla con la angiografía sin guía, en estos casos no se puede obtener una medición fiable de la presión distal.
Efecto de la presión hidrostática: al realizar la medición de la presión se asume que los transductores están a la misma altura del corazón, cosa que sucede al realizar la ecualización, pero al realizar mediciones en la circunfleja distal o en la coronaria derecha distal, existe cierta presión hidrostática que podría incrementar la medición de la Pd/Pa en 0.01 a 0.04 puntos, esto es especialmente evidente en arterias sin estenosis.
Efecto de la presión venosa central (Pv): de forma práctica se considera que la presión venosa es despreciable, por lo que la fórmula original del FFR (Pd-Pv/Pa-Pv) se simplifica en Pd/Pa. El incremento de la Pv ocasiona que disminuya el FFR. Sin embargo y dado que los estudios se han realizado ignorando el efecto de la Pv, no es necesaria su medición en casos de angina estable. Se podría considerar de valor en pacientes con insuficiencia cardiaca o hipotensos, en los que la influencia de la Pv es mayor.
Limitaciones de los métodos para inducir hiperemia: Las metilxantinas, como la cafeína, teobromina (chocolate) y la teofilina son antagonistas competitivos del receptor de adenosina, por lo que se recomienda suspender su uso 24 horas antes de un estudio en el que se vaya a utilizar adenosina para obtener una adecuada respuesta hiperémica. La administración de adenosina IC o una perfusión de dosis más altas de adenosina IV (210 µg/kg/min) pueden disminuir, al menos parcialmente, el efecto de la cafeína; pero la tolerancia a dosis mayores de adenosina es menor, con aparición de más efectos adversos24.
Escenarios específicos
- Enfermedad coronaria difusa: el realizar una retirada continua de la guía de presión de distal a proximal puede ayudar a identificar un área focal de estenosis, evidenciando un incremento abrupto de la presión, o confirmar la presencia de aterosclerosis difusa, dónde la recuperación de la presión es gradual a lo largo de toda la arteria; esta información ayuda a determinar si es útil la realización de angioplastia, incluso en algunos casos se puede encontrar una lesión focal superpuesta a la estenosis difusa que merece ser tratada.
- Lesiones ostiales: es útil para evaluar lesiones aorto-ostiales, y principalmente ramas laterales enjauladas, difíciles de evaluar con angiografía por acortamientos y superposición de imágenes. En un estudio de 94 lesiones en ramas enjauladas, sólo 27% de las lesiones con estenosis de más del 75% por QCA fueron significativas por FFR y ninguna lesión con estenosis menor del 75% presentó FFR <0.7525. En el caso de lesiones aorto-ostiales es importante retirar el catéter guía del ostium, tanto para la ecualización como para las mediciones, para evitar que el catéter impida el flujo coronario.
- Estenosis aórtica: muchos pacientes con estenosis aórtica tienen a su vez EC. La estenosis aórtica severa genera resistencias microvasculares aumentadas y una reserva vasodilatadora disminuida, lo que puede afectar las mediciones de FFR. En pacientes que se estudió el FFR pre- y post-TAVI con adenosina intracoronaria sólo se observaron cambios menores en los valores del FFR, sugiriendo seguridad y validez del estudio con FFR de estos pacientes. La actitud a seguir cambia en aproximadamente 15% de los pacientes, especialmente en lesiones intermedias por angiografía26.
- Síndrome coronario agudo (SCA): después de un infarto agudo, la capacidad predictiva del FFR tiene algunas limitaciones teóricas. Debido a la afectación microvascular, la respuesta a los estímulos hiperémicos es variable, se reduce el flujo a través de la estenosis y aumenta el FFR. En el contexto de IAMCEST, al estudiar una lesión no culpable, un FFR bajo indica una estenosis significativa; aunque un FFR normal puede no ser definitivo, la probabilidad de que se trate de una lesión severa con FFR>0.80 es baja27. Los resultados del estudio FAME en relación con pacientes con angina inestable o IAMSEST, en los que la revascularización se realizó guiada por FFR, presentaron una reducción relativa del riesgo de eventos cardiovasculares mayores del 19% respecto a la revascularización guiada por angiografía, con un beneficio similar que los pacientes con angina estable (reducción absoluta del riesgo de 5.1% vs. 3.7%, p=0.92) y una reducción de la necesidad de stents implantados28.
Múltiples estudios han demostrado que revascularizar los vasos no culpables en pacientes que han tenido un IAMCEST reduce los eventos adversos, sin que se haya podido demostrar un beneficio adicional de valorar dichas lesiones con FFR, más allá de reducir el número de stents implantados, que no es un beneficio menor29.
La isquemia miocárdica induce disfunción microvascular no sólo en el territorio irrigado por la arteria culpable30, lo que puede llevar a la medición de un FFR falso negativo. El punto de corte del FFR en pacientes con un SCA es un tema de discusión, el estudio de Hakeem et al mostró que los pacientes con FFR menor de 0.85 tenían un mayor número de eventos adversos31. Al comparar la evolución del FFR con el iFR, un mes después de un IAMCEST, se observa una disminución del FFR con un iFR estable, en relación con un incremento de la resistencia microvascular hiperémica32, lo que sugiere que los índices no hiperémicos puedan ser una mejor opción en el contexto del SCA.
Un análisis de datos individuales de 5 grandes estudios (8579 pacientes), muestra que, en comparación con la angina estable, la seguridad de diferir la revascularización en SCA con FFR es menor; sin embargo, el tratar parece no disminuir el número de eventos mayores33. Recientemente, un estudio realizado en pacientes con IAMCEST y enfermedad multivaso, en los que se evaluó las lesiones no culpables con FFR, se evidenció un mayor número de eventos en los pacientes que se difirió la revascularización basada en FFR >0.80 respecto a los que se revascularizó basados en la angiografía34. Estos resultados ejemplifican la complejidad diagnóstica en el escenario del SCA.
- Medición post-angioplastia coronaria: La realización de FFR post-procedimiento ha demostrado una correlación entre resultados sub-óptimos, enfermedad residual y pronóstico35. Dos estudios, FFR SEARCH (Fractional FlowReserve–Stent Evaluated at Rotterdam Cardiology Hospital)36 y Target FFR (An Evaluation of a Physiology-Guided PCI Optimisation Strategy)37 mostraron que hasta el 68% de los pacientes a los que se les ha tratado una lesión coronaria persisten con alguna lesión con FFR ≤0.90, y un 11% presentan lesiones con FFR ≤0.80. Existe una relación inversa, continua e independiente entre el FFR post-procedimiento y la aparición de eventos (HR: 0.86; IC 95%: 0.80 a 0.93, p<0.001)38. El valor óptimo de FFR post-procedimiento para disminuir los eventos cardiovasculares debería ser mayor de 0.8535. En cuanto a los índices de reposo, la relación Pd/Pa >0.96 se relaciona adecuadamente con un FFR >0.86 y con la menor tasa de eventos adversos39. El resultado fisiológico depende de varios factores, incluyendo longitud y diámetro de los stents, así como la afectación de la DA. En el caso de los índices de reposo, el estudio DEFINE-PCI (Physiologic Assessment of Coronary Stenosis Following PCI) mostró que 24% de los pacientes tenían isquemia residual (iFR ≤0.89) después de una angioplastia exitosa, con un 81.6% de los casos atribuible a lesiones focales angiográficamente no visibles. Un iFR post-procedimiento ≥0.95 se asoció a una mejor supervivencia libre de eventos al año y una mayor reducción de los síntomas anginosos40. Sugiriendo la importancia de evaluar los resultados del procedimiento con fisiología.
Índices derivados de la angiografía:
Evidencia científica
El estudio fisiológico de las estenosis epicárdicas se encuentra limitado en la práctica clínica habitual por la necesidad del uso de una guía de presión y en algunos casos, de agentes hiperémicos, que conllevan un aumento de coste de procedimiento y la posibilidad de efectos secundarios41. Por este motivo, se han generado nuevos índices derivados de la angiografía tales como el QFR, FFRAngio, CAAS-vFFR o vFFR. Estos índices se basan en la reconstrucción tridimensional del árbol coronario a través de la angiografía, usando posteriormente dinámica computacional de fluidos (CFD) o simplificaciones matemáticas de ésta como subrogado del flujo coronario.
El QFR (Quantitative Flow Ratio; Qangio XA 3D, Medis Medical Imaging Systems, Leiden, The Netherlands), emplea una reconstrucción 3D de la angiografía y posteriormente, asumiendo una presión y velocidad de flujo constante a lo largo de un vaso epicárdico normal, se computa un proxy del valor de FFR a través de distintos modelos: el modelo fijo (fQFR) usa información de una base de datos en la que previamente se han obtenido valores FFR y velocidades de flujo; el modelo de QFR-contraste (cQFR) que tiene en cuenta la velocidad a la que fluye el contraste administrado en la arteria epicárdica mediante contaje de frames; y el modelo QFR-adenosina (aQFR) que lo valora tras la inducción de hiperemia mediante administración de adenosina. Los tres modelos han sido evaluados frente a FFR obteniéndose una mejor precisión diagnóstica con los modelos QFR-adenosina (87%) y QFR-contraste (86%)42. Varios estudios posteriores han demostrado la utilidad y alta precisión de este método para el diagnóstico funcional de una estenosis epicárdica43,44 así como la seguridad que confiere la decisión de revascularización o no basada en éste45,46. El estudio FAVOR III China, que incluyó 3825 pacientes, demostró una disminución de los eventos mayores (HR: 0.65, IC 95%: 0.51 a 0.83, p=0.0004) en los pacientes que se difirió la revascularización basados en un QFR ≤0.80, impulsado por menos infartos de miocardio y menos revascularizaciones guiadas por isquemia, comparado con la revascularización guiada por angiografía47.
Otro índice es el CAAS-FFR (Cardiovascular Angiographic Analysis System for Vessel FFR, CAAS-vFFR, Pie Medical, Maastricht, Netherlands). Se basa en el uso de reconstrucción 3D de la angiografía adquirida y posterior computación del gradiente de presión a través de una lesión. Su estudio de validación incluyó a pacientes con enfermedad estable y SCASEST y mostró una precisión del 93% para el diagnóstico de lesiones con FFR ≤0.80 así como una correlación interobservador del 95%48.
Ampliamente usado es también el índice FFRAngio (Cathworks, Kfar-Sba, Israel) que emplea, a diferencia de los previos, al menos tres proyecciones angiográficas para realizar un mapeado funcional 3D. Fearon et al49 lo evaluaron en una amplia población objetivando una sensibilidad del 94%, especificidad del 91% y precisión diagnóstica del 92% para valores de FFR ≤0.80 con alta consistencia interobservador (96%).
Existen además otros índices como puede ser el vFFR (Virtual Fractional Flow reserve, VirtuHeart Medical Physics Group, Sheffield, UK) que en su estudio de validación llegó a demostrar una alta precisión diagnóstica, sensibilidad y especificidad (97%, 86% y 100% respectivamente)50, si bien aún se encuentra en fase de experimentación.
Recientemente, un metanálisis realizado por Collet et al51, ha mostrado las mediciones de FFR derivadas de la angiografía presentan una sensibilidad global del 89% y especificidad del 90% respecto al FFR invasivo. No obstante, es posible que exista una zona gris relativamente amplia (0.75-0.86) en la que la determinación invasiva del FFR podría estar indicada52. Asumiendo esta zona gris, la precisión diagnóstica de estos métodos podría llegar a ser superior al 95% tal y como se demostró en el estudio FAVOR II China53 puede llegar a evitar la necesidad de estudio invasivo en hasta el 64% de lesiones54.
A pesar de resultados tan prometedores, este tipo de análisis conllevan ciertas limitaciones. Una de las principales dificultades es obtener angiografías adecuadas para analizar, sin “panning” ni superposición de estructuras55. Otra limitación viene determinada por la anatomía de la lesión a estudio, ya que lesiones ostiales o en bifurcación presentan mayor dificultad para delinear su contorno y, por tanto, su análisis podría verse sesgado. En un análisis reciente sobre la población participante en el estudio SYNTAX II, la evaluación por QFR frente a la estrategia híbrida iFR/FFR mostró una precisión diagnóstica del QFR cercana al 74%, con un 8.3% de falsos positivos y 17.9% de falsos negativos, siendo el principal motivo de esta discordancia el estudio de lesiones en ramas marginales, pequeños vasos o en zonas de bi o trifurcación56. Además, de especial interés resulta el estado de la microcirculación en el paciente a estudio, ya que estas técnicas asumen una máxima vasodilatación para computar presión desde el flujo obtenido.
No obstante, el grado de respuesta a hiperemia -ya sea por contraste o por agentes hiperémicos farmacológicos- es variable en función del estado de la microcirculación de cada paciente pudiendo incurrir en error. Mejía-Rentería et al estudiaron la influencia que el estado de la microcirculación podría ejercer sobre este tipo de evaluaciones no invasivas de la CFR, observando que la mayor fuente de discordancia venía dada por una alteración en la función microvascular, medida como un valor alterado de IMR o situación de infarto agudo de miocardio57. Se podría pensar que el tiempo de procesado de la imagen y su análisis puede ser mayor al de realización de estudio fisiológico con guía de presión. No obstante, una vez entrenado, se ha demostrado que el estudio se puede realizar de forma incluso más rápida que la determinación clásica de FFR58,59. Por último, una limitación pendiente de resolver es la variabilidad (concordancia de 0.01±0.08 para medidas repetidas), que es dependiente del observador, la calidad de la angiografía y el grado de estenosis valorado por FFR60.
Bibliografía
- Volcano. Instrucciones de uso ComboWire. Published 2019. Accessed February 22, 2022. https://www.documents.philips.com/
- Ficha técnica OptoWireTM III - OpSens. Accessed March 22, 2022. https://opsensmedical.com/products/optowire/
- Jeremias A, Filardo SD, Whitbourn RJ, et al. Effects of Intravenous and Intracoronary Adenosine 5′-Triphosphate as Compared With Adenosine on Coronary Flow and Pressure Dynamics. Circulation. 2000;101(3).
- Nakayama M, Chikamori T, Uchiyama • Takashi, et al. Effects of caffeine on fractional flow reserve values measured using intravenous adenosine triphosphate. doi:10.1007/s12928-017-0456-y
- Koo BK, Kang HJ, Youn TJ, et al. Physiologic Assessment of Jailed Side Branch Lesions Using Fractional Flow Reserve. J Am Coll Cardiol. 2005;46(4):633-637. doi:10.1016/J.JACC.2005.04.054
- Pesarini G, Scarsini R, Zivelonghi C, et al. Functional Assessment of Coronary Artery Disease in Patients Undergoing Transcatheter Aortic Valve Implantation: Influence of Pressure Overload on the Evaluation of Lesions Severity. Circ Cardiovasc Interv. 2016;9(11). doi:10.1161/CIRCINTERVENTIONS.116.004088
- Ntalianis A, Sels JW, Davidavicius G, et al. Fractional flow reserve for the assessment of nonculprit coronary artery stenoses in patients with acute myocardial infarction. JACC Cardiovasc Interv. 2010;3(12):1274-1281. doi:10.1016/J.JCIN.2010.08.025
- Sels JWEM, Tonino PAL, Siebert U, et al. Fractional flow reserve in unstable angina and non-ST-segment elevation myocardial infarction experience from the FAME (Fractional flow reserve versus Angiography for Multivessel Evaluation) study. JACC Cardiovasc Interv. 2011;4(11):1183-1189. doi:10.1016/J.JCIN.2011.08.008
- Zhao L, Guo W, Huang W, et al. Comparative Effectiveness of Complete Revascularization Strategies in Patients With ST-Segment Elevation Myocardial Infarction and Multivessel Disease: A Bayesian Network Meta-Analysis. Frontiers in Cardiovascular Medicine. 2021;8:724274. doi:10.3389/FCVM.2021.724274
- Uren NG, Crake T, Lefroy DC, de Silva R, Davies GJ, Maseri A. Reduced Coronary Vasodilator Function in Infarcted and Normal Myocardium after Myocardial Infarction. http://dx.doi.org/101056/NEJM199407283310402. 2010;331(4):222-227. doi:10.1056/NEJM199407283310402
- Hakeem A, Edupuganti MM, Almomani A, et al. Long-Term Prognosis of Deferred Acute Coronary Syndrome Lesions Based on Nonischemic Fractional Flow Reserve. J Am Coll Cardiol. 2016;68(11):1181-1191. doi:10.1016/J.JACC.2016.06.035
- van der Hoeven NW, Janssens GN, de Waard GA, et al. Temporal Changes in Coronary Hyperemic and Resting Hemodynamic Indices in Nonculprit Vessels of Patients With ST-Segment Elevation Myocardial Infarction. JAMA Cardiology. 2019;4(8):736-744. doi:10.1001/JAMACARDIO.2019.2138
- Cerrato E, Mejía-Rentería H, Dehbi HM, et al. Revascularization Deferral of Nonculprit Stenoses on the Basis of Fractional Flow Reserve: 1-Year Outcomes of 8,579 Patients. JACC Cardiovasc Interv. 2020;13(16):1894-1903. doi:10.1016/j.jcin.2020.05.024
- Denormandie P, Simon T, Cayla G, et al. Compared Outcomes of ST-Segment–Elevation Myocardial Infarction Patients With Multivessel Disease Treated With Primary Percutaneous Coronary Intervention and Preserved Fractional Flow Reserve of Nonculprit Lesions Treated Conservatively and of Those With Low Fractional Flow Reserve Managed Invasively: Insights From the FLOWER-MI Trial. Circulation: Cardiovascular Interventions. 2021;14(11):e011314. doi:10.1161/CIRCINTERVENTIONS.121.011314
- van Zandvoort LJC, Ali Z, Kern M, van Mieghem NM, Mintz GS, Daemen J. Improving PCI Outcomes Using Postprocedural Physiology and Intravascular Imaging. Published online 2021. doi:10.1016/j.jcin.2021.08.069
- van Bommel RJ, Masdjedi K, Diletti R, et al. Routine Fractional Flow Reserve Measurement After Percutaneous Coronary Intervention. Circ Cardiovasc Interv. 2019;12(5):e007428. doi:10.1161/CIRCINTERVENTIONS.118.007428
- Collison D, Didagelos M, Aetesam-ur-Rahman M, et al. Post-stenting fractional flow reserve vs coronary angiography for optimization of percutaneous coronary intervention (TARGET-FFR). Eur Heart J. 2021;42(45):4656-4668. doi:10.1093/EURHEARTJ/EHAB449
- Johnson NP, Tóth GG, Lai D, et al. Prognostic value of fractional flow reserve: linking physiologic severity to clinical outcomes. J Am Coll Cardiol. 2014;64(16):1641-1654. doi:10.1016/J.JACC.2014.07.973
- Hakeem A, Ghosh B, Shah K, et al. Incremental Prognostic Value of Post-Intervention Pd/Pa in Patients Undergoing Ischemia-Driven Percutaneous Coronary Intervention. JACC Cardiovasc Interv. 2019;12(20):2002-2014. doi:10.1016/J.JCIN.2019.07.026
- Patel MR, Jeremias A, Maehara A, et al. 1-Year Outcomes of Blinded Physiological Assessment of Residual Ischemia After Successful PCI: DEFINE PCI Trial. JACC Cardiovasc Interv. 2022;15(1):52-61. doi:10.1016/J.JCIN.2021.09.042
- Barauskas M, Ziubryte G, Barauskiene G, Unikaite R, Jodka N, Unikas R. Systemic analysis of diagnostic performance and agreement between fractional flow reserve and quantitative flow ratio. Cor et Vasa. 2021;63(6):683-687. doi:10.33678/cor.2021.060
- Tu S, Westra J, Yang J, et al. Diagnostic Accuracy of Fast Computational Approaches to Derive Fractional Flow Reserve From Diagnostic Coronary Angiography The International Multicenter FAVOR Pilot Study.; 2016.
- Xu B, Tu S, Qiao S, et al. Diagnostic Accuracy of Angiography-Based Quantitative Flow Ratio Measurements for Online Assessment of Coronary Stenosis. J Am Coll Cardiol. 2017;70:3077-3087.
- Westra J, Tu S, Campo G, et al. Diagnostic performance of quantitative flow ratio in prospectively enrolled patients: An individual patient-data meta-analysis. Catheterization and Cardiovascular Interventions. 2019;94(5):693-701. doi:10.1002/ccd.28283
- Spitaleri G, Tebaldi M, Biscaglia S, Westra J, Brugaletta S, Erriquez A. Quantitative Flow Ratio identifies nonculprit coronary lesions requiring revascularization in patients with ST segment elevation myocardial infarction and multivessel disease. Circ Cardiovasc Interv. 2018;11(e006023).
- Xu B, Tu S, Song L, et al. Angiographic quantitative flow ratio-guided coronary intervention (FAVOR III China): a multicentre, randomised, sham-controlled trial. The Lancet. 2021;398(10317):2149-2159. doi:10.1016/S0140-6736(21)02248-0
- Xu B, Tu S, Song L, et al. Angiographic quantitative flow ratio-guided coronary intervention (FAVOR III China): a multicentre, randomised, sham-controlled trial. Lancet. 2021;398(10317):2149-2159. doi:10.1016/S0140-6736(21)02248-0
- Masdjedi K, Tanaka N, Van Belle E, et al. Vessel fractional flow reserve (vFFR) for the assessment of stenosis severity: the FAST II study. EuroIntervention. Published online 2021. doi:10.4244/EIJ-D-21-00471
- Fearon W, Achenbach S, Engstrom T, et al. Accuracy of fractional flow reserve derived from coronary angiography. Circulation. 2019;139:477-484.
- Morris PD, Ryan D, Morton AC, et al. Virtual Fractional Flow Reserve From Coronary Angiography: Modeling the Significance of Coronary Lesions Results From the VIRTU-1 (VIRTUal Fractional Flow Reserve From Coronary Angiography) Study. J Am Coll Cardiol Intv. 2013;6:149-157.
- Collet C, Onuma Y, Sonck J, et al. Diagnostic performance of angiography-derived fractional flow reserve: A systematic review and Bayesian meta-analysis. European Heart Journal. 2018;39(35):3314-3321. doi:10.1093/eurheartj/ehy445
- Yakazi K, Otsuka M, Kataoka S, Kahata, Kumagai A. Applicability of 3-Dimensional Quantitative Coronary Angiography-derived computed Fractional Flow Reserve for intermediate coronary stenosis. Circ J. 2017;81:988-992. doi:10.1253/circj.CJ-16-1261
- Xu B, Tu S, Qiao S, et al. Diagnostic Accuracy of Angiography-Based Quantitative Flow Ratio Measurements for Online Assessment of Coronary Stenosis. J Am Coll Cardiol. 2017;70:3077-3087.
- Collet C, Onuma Y, Sonck J, et al. Diagnostic performance of angiography-derived fractional flow reserve: A systematic review and Bayesian meta-analysis. European Heart Journal. 2018;39(35):3314-3321. doi:10.1093/eurheartj/ehy445
- Asano T, Katagiri Y, Chang CC, et al. Angiography-Derived Fractional Flow Reserve in the SYNTAX II Trial: Feasibility, Diagnostic Performance of Quantitative Flow Ratio, and Clinical Prognostic Value of Functional SYNTAX Score Derived From Quantitative Flow Ratio in Patients With 3-Vessel Dis. JACC: Cardiovascular Interventions. 2019;12(3):259-270. doi:10.1016/j.jcin.2018.09.023
- Asano T, Katagiri Y, Chang CC, et al. Angiography-Derived Fractional Flow Reserve in the SYNTAX II Trial: Feasibility, Diagnostic Performance of Quantitative Flow Ratio, and Clinical Prognostic Value of Functional SYNTAX Score Derived From Quantitative Flow Ratio in Patients With 3-Vessel Dis. JACC: Cardiovascular Interventions. 2019;12(3):259-270. doi:10.1016/j.jcin.2018.09.023
- Mejía-Rentería H, Lee JM, Lauri F, et al. Influence of Microcirculatory Dysfunction on Angiography-Based Functional Assessment of Coronary Stenoses. JACC: Cardiovascular Interventions. 2018;11(8):741-753. doi:10.1016/j.jcin.2018.02.014
- Westra J, Andersen BK, Campo G, et al. Diagnostic performance of in-procedure angiography-derived quantitative flow reserve compared to pressure-derived fractional flow reserve: The FAVOR II Europe-Japan study. J Am Heart Assoc. 2018;7(14). doi:10.1161/JAHA.118.009603
- Haley H, Ghobrial M, Morris P, Gosling R, Williams G, Mills M. Virtual (computed) Fractional Flow Reserve: Future role in acute coronary syndromes. Front Cardiovasc Med. 2021;8(735008).
- Westra J, Sejr-Hansen M, Koltowski L, et al. Reproducibility of quantitative flow ratio: The QREP study. EuroIntervention. 2022;17(15):1252-1259. doi:10.4244/EIJ-D-21-00425







