Acceso transcarotídeo
El reemplazo percutáneo de la válvula aórtica (TAVI) ha demostrado ser una excelente alternativa[1] en el tratamiento de la estenosis aórtica.
Actualmente, alrededor del 75 a 80% de los pacientes se realiza por vía femoral (TF), lo que lo convierte en el acceso de elección. El acceso trans-apical (TA) es la alternativa más común cuando la vía TF no está disponible[2]. La mayoría de las publicaciones que lo comparan con la vía TF han evidenciado peor evolución post TAVI en relación a muerte y eventos cardiovasculares[2, 3]. El acceso TA es especialmente desventajoso en: portadores de patología pulmonar severa o pacientes extremadamente frágiles que toleran peor la realización de una minitoracotomía. Adicionalmente, existe riesgo teórico de empeorar el funcionamiento de los ventrículos severamente deprimidos.
Otras alternativas son los accesos Subclavio (SC) o transaórtico directo (TAo) utilizados en menor proporción. El acceso SC es desaconsejable en pacientes portadores de by-pass mamario por el riesgo de lesionar su origen, dado que la presencia de tortuosidad subclavia dificulta el avance de la prótesis. Un estudio observacional recientemente publicado compara los 4 accesos ya mencionados evidenciando que, tanto los casos realizados por accesos TA como TAo, tuvieron un peor pronóstico en relación a muerte y eventos cardiovasculares a corto y mediano plazo[4]. Ningún acceso alternativo ha mostrado ser una alternativa óptima a la vía TF, motivando la evaluación del acceso transcarotídeo (TCa) como opción.
Los primeros dos casos exitosos de tratamiento percutáneo de la EAo vía TCa fueron descritos en neonatos[5]. Evidentemente, existen importantes diferencias en la patología de adultos, siendo relevante la presencia de ateromatosis carotídea. La evidencia más cercana disponible en instrumentalización percutánea de la carótida corresponde a la angioplastia carotídea.
Una revisión sistemática que involucró más de 1.500.000 casos de angioplastia o endarterectomía carotídea, reveló que la tasa de mortalidad o accidente cerebrovascular (ACV) post angioplastia es en promedio 3%[6].
El primer caso de TAVI vía TCa fue reportado por el grupo de Modine (Hospital de Lille, Francia). La tortuosidad extrema de la aorta abdominal y subclavia derecha fueron los motivos para elegir vía TCa[7]. El mismo grupo, reportó en el año 2012 una serie de 12 casos de EAo severa, portadores de enfermedad vascular periférica severa. Se realizó TAVI vía TCa izquierda con 100% de éxito, la tasa de reflujo aórtico grado III-IV post TAVR fue cero[8]. El grupo de Azmoun reportó en el 2013 la realización de TAVI vía TCa en 19 pacientes, con éxito en 18. Esto correspondió al 10% de su población sometida a TAVI. Este grupo utilizó prótesis Corevalve™ y Sapien XT™.
Hasta el momento, la experiencia más importante en la literatura corresponde al Registro Francés de TAVI TCa llevado a cabo en 3 centros entre los años 2009 y 2013. Se efectuaron 96 casos, todos portadores de enfermedad periférica severa. Se logró implante TAVI exitoso vía TCa en 100%, se utilizó dispositivo Corevalve™ en 93% de los casos. La mortalidad asociada al procedimiento fue 3.1%, la incidencia de eventos cerebrovasculares fue 3.1% siendo todos casos de isquemia aguda transitoria (TIA)[9].
La inserción del introductor y material endovascular de gran calibre a nivel de la arteria carótida común conlleva riesgo de isquemia cerebral. En consecuencia, previo al procedimiento se debe verificar: un adecuado calibre a nivel de la carótida común para la inserción de la prótesis, la ausencia de ateromatosis severa y presencia de una adecuada compensación de flujo cerebral.
La ecografía Doppler carotídea permite evaluar lo que se complementa con la tomografía axial computada (TAC) efectuada habitualmente pre-TAVI. Ésta nos permite caracterizar el trayecto, la presencia de placas de ateroma y el calibre carotídeo. Según lo reportado en la literatura, el calibre mínimo exigido para la carótida común varía entre 6 y 7mm de acuerdo a los diferentes grupos[9, 10].
Para verificar la presencia de circulación colateral y permeabilidad del polígono de Willis, el registro Francés TCa utilizó la resonancia magnética (RM) previo a la intervención. Sin embargo, es un tema en discusión y otra opción es comprobar la circulación colateral mediante métodos indirectos. Se puede efectuar de modo práctico durante la intervención: al exponer la carótida común se realiza “clampeo”, se verifica la presión de perfusión distal 1 minuto post oclusión, la cual no debe caer a menos de 30mmHg o y la saturometría cerebral en más de 50%[11].
En caso de efectuar el procedimiento bajo anestesia local, la respuesta a evaluar es la consciencia. La pérdida de consciencia a los 3 minutos de clampeo, se considera circulación colateral insuficiente y requiere establecer un shunt transitorio para realizar la TAVI[10]. Adicionalmente a lo anterior, se realiza oximetría cerebral bilateral durante todo el procedimiento, sin embargo, no hay cifras límite consensuadas.
Teóricamente, instrumentalizar el territorio carotideo podría derivar en una mayor incidencia de accidente cerebrovascular (ACV) o isquemia cerebral transitoria (TIA). El registro Francés TCa reportó un 3.1% de eventos neurológicos post-procedimiento y un 6% a 30 días, todos AIT. Los grupos de Azmoun y Thourani con 18 y 11 casos, reportan 0% ACV a 30días[4, 10].
En nuestra experiencia local, de 16 casos realizados se registró 1 ACV. Es posible que los buenos resultados obtenidos se deban a una adecuada selección de pacientes y la exclusión de aquellos cuya anatomía o carga de ateromatosis carotídea es desfavorable. Las cifras mencionadas se comparan favorablemente con registros internacionales[12] y podremos obtener conclusiones una vez que contemos con mayores registros vía TCa. En ninguno de los estudios mencionados hubo complicaciones vasculares mayores del acceso carotídeo.
Para realizar TAVI vía TCa no se requieren materiales diferentes a los utilizados por la vía TF. La proximidad del acceso carotídeo en relación a la raíz aórtica y la alineamiento coaxial logrado al usar la vía TCa izquierda entregan una adecuada libertad de movimiento, así como también favorecen el control y correcto posicionamiento de la prótesis.
La ubicación superficial de la carótida común permite al equipo quirúrgico lograr fácilmente el acceso y no es habitual que se requiera establecer un shunt adicional para garantizar la perfusión. A diferencia de los accesos que requieren una mini-toracotomía, el acceso TCa permite ofrecer la posibilidad de efectuar el procedimiento bajo anestesia local.
Otro punto importante, y pese a no estar mencionado explícitamente dentro de los resultados relevantes, es la excelente tolerancia de los pacientes al procedimiento y posterior a éste, permitiendo una rápida recuperación de la deambulación.
Acceso carotídeo izquierdo vs derecho: en el registro Francés se definió acceso TCa izquierdo como la elección, ya que permite un alineamiento coaxial de la prótesis con la raíz aórtica. Al contrario, una presentación oral reciente por Cohen y cols., de 27 casos de TAVI vía TCa, 20 se efectuaron por la vía derecha de modo exitoso[13]. El grupo de Azmoun realizó el 44% de sus implantes por vía derecha[10].
Con respecto a la anestesia, la experiencia más amplia publicada ha sido en relación a procedimientos realizados bajo anestesia general con alta tasa de éxito y baja tasa de complicaciones. Existen reportes de casos o series realizadas bajo anestesia local con igualmente buenos resultados[10, 14]. Esto puede otorgar ventajas adicionales en pacientes portadores de enfermedad pulmonar severa y favorecer la estabilidad hemodinámica.
Basado en las ventajas del acceso TCa, algunos grupos en Francia lo proponen como primera opción frente al transapical, en pacientes con mal acceso femoral. No existen estudios que comparen ampliamente el acceso TA versus TCa, salvo una serie recientemente publicada por Thourani comparando diferentes accesos alternativos: 139 pacientes realizados por vía TA y 11 pacientes vía TCa. Pese al score STS significativamente mayor en grupo TCa, la incidencia de eventos cardiovasculares y muerte post TAVI fue similar para ambos grupos[4].
Como conclusión podemos decir que el acceso TCa es una alternativa efectiva para efectuar TAVI. Su utilización requiere un estudio previo de la anatomía y permeabilidad del eje vascular carotídeo. La evidencia publicada hasta el momento avala su seguridad, lo que lo posiciona como un acceso a considerar en pacientes portadores de ateromatosis ilíaco-femoral severa.
PASO A PASO
Paso 1: Verificar el cumplimiento de criterios previamente establecidos para el uso del acceso[15]. Es aconsejable planificar un acceso alternativo en caso de fracaso y tener el equipo quirúrgico preparado en caso de complicación mayor.
Paso 2: Colocación de marcapaso transitorio vía yugular y, en caso de utilizar ecocardiografía transesofágica, se coloca posterior a la intubación endotraqueal de la anestesia general.
Paso 3: Se obtiene un acceso arterial para insertar un catéter pigtail, siendo la vía radial derecha nuestra primera elección, teniendo en cuenta que este grupo de pacientes presenta severa ateromatosis del eje ilio-femoral[16].
Paso 4: Incisión cervical (Figura 1): Habitualmente utilizamos la vía TCa izquierda. Sin embargo la vía derecha es igualmente factible[17]. La incisión se efectúa a lo largo del borde medial del músculo esternocleidomastoideo. Se efectúan 2 suturas hemostáticas[4].
Paso 5: Integridad funcional del polígono de Willis (Figura 2): Se efectúa un clampeo de la arteria carótida común durante 1 minuto, se verifica la presión arterial inmediatamente distal a la zona de clampeo y la oximetría cerebral.[18]
Paso 6: Se punza la carótida común entre las dos suturas hemostáticas y se avanza un guía 0.035” estándar con extremo curvo hasta la raíz aórtica . Se inserta un introductor 7 French. Para el cruce de la válvula aórtica se puede utilizar un catéter Judkins™ derecho, Amplatz™ izquierdo o Multipropósito. Guía recta 0.035” hacia el ventrículo izquierdo o guía hidrofílica.
Paso 7: Guía rígida 0.035” posicionándola dentro del ventrículo y se avanza el introductor correspondiente a la prótesis valvular a implantar (Figura 3).
Paso 8: En caso que el equipo haya definido pre-dilatar previo al implante, se avanza un balón, se efectúa estimulación ventricular rápida y se efectúa valvuloplastía.
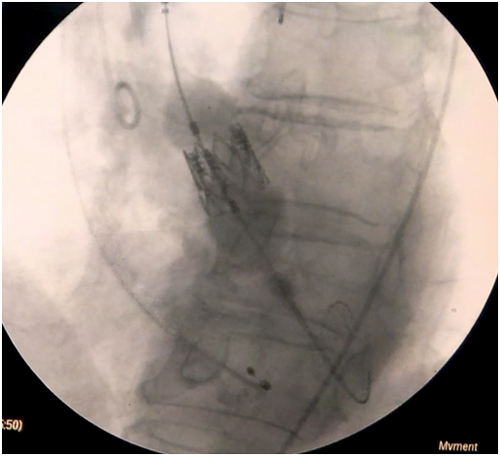
Paso 9: Al no existir curvaturas pronunciadas desde la carótida a la raíz aórtica, el avance del dispositivo debiese ser sin dificultad (Figura 4). En la aortografía se deben visualizar los 3 velos aórticos y el ángulo imaginario formado por el eje aórtico y la raíz aórtica debe aproximarse a 90º(19).
Lo anterior alinear de modo simor referencia posible de la raes. je irotsimétrico la prótesis valvular a la raíz aórtica, independiente del tipo de prótesis a utilizar. Para verificar la adecuada posición de la prótesis, se puede efectuar una ventriculografía previo a su despliegue. En caso de ser un dispositivo expandible con balón, se requiere estimulación ventricular rápida. En el despliegue de una prótesis autoexpandible, no se requiere estimulación ventricular a menos que exista dificultad en estabilizar el sistema.
Paso 10: Se evalúa ecográficamente la presencia de reflujo aórtico.
Paso 11: Se retira completamente el introductor desde la carótida, evitando el sangrado mediante las suturas hemostáticas y el cirujano repara el lecho vascular carotídeo. Posterior a esto, se verifica sonográficamente el flujo carotídeo proximal y distal a la incisión efectuada
Paso 12: Monitorización en sala de cuidados críticos.
Figuras
Figura 1: Incisión cervical
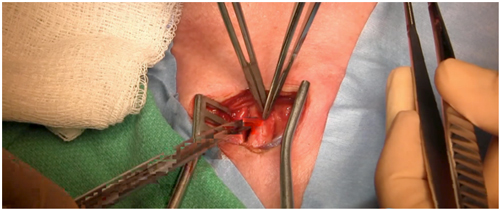
Figura 2: Verificación de la integridad funcional de la carótida
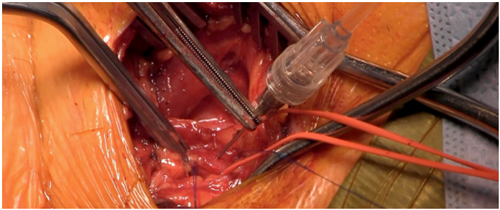
Figura 3: Introductor de la prótesis
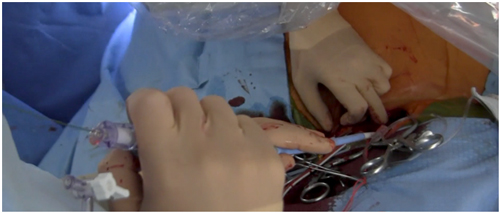
Figura 4: Posicionamiento de la prótesis
Bibliografía
- Smith, C.R., et al., Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med, 2011. 364(23): p. 2187-98.
- Frohlich, G.M., et al., Comparative survival after transapical, direct aortic, and subclavian transcatheter aortic valve implantation (data from the UK TAVI registry). Am J Cardiol, 2015. 116(10): p. 1555-9.
- Blackstone, E.H., et al., Propensity-matched comparisons of clinical outcomes after transapical or transfemoral transcatheter aortic valve replacement: a placement of aortic transcatheter valves (PARTNER)-I trial substudy. Circulation, 2015. 131(22): p. 1989-2000.
- Thourani, V.H., et al., High-risk patients with inoperative aortic stenosis: use of transapical, transaortic, and transcarotid techniques. Ann Thorac Surg, 2015. 99(3): p. 817-23; discussion 823-5.
- Weber, H.S., C.R. Mart, and J.L. Myers, Transcarotid balloon valvuloplasty for critical aortic valve stenosis at the bedside via continuous transesophageal echocardiographic guidance. Catheter Cardiovasc Interv, 2000. 50(3): p. 326-9.
- Paraskevas, K.I., E.L. Kalmykov, and A.R. Naylor, Stroke/Death Rates Following Carotid Artery Stenting and Carotid Endarterectomy in Contemporary Administrative Dataset Registries: A Systematic Review. Eur J Vasc Endovasc Surg, 2016. 51(1): p. 3-12.
- Modine, T., et al., Implantation of a Sapien XT aortic bioprosthesis through the left carotid artery. J Card Surg, 2014. 29(3): p. 337-9.
- Modine, T., et al., Transcutaneous aortic valve implantation using the left carotid access: feasibility and early clinical outcomes. Ann Thorac Surg, 2012. 93(5): p. 1489-94.
- Mylotte, D., et al., Transcarotid Transcatheter Aortic Valve Replacement: Feasibility and Safety. JACC Cardiovasc Interv, 2016. 9(5): p. 472-80.
- Azmoun, A., et al., Transcatheter aortic valve implantation through carotid artery access under local anaesthesia. Eur J Cardiothorac Surg, 2014. 46(4): p. 693-8; discussion 698.
- Campelo-Parada, F., et al., A Novel Transcarotid Approach for Implantation of Balloon-Expandable or Self-Expandable Transcatheter Aortic Valves. Can J Cardiol, 2016.
- Murashita, T., et al., Clinical Outcomes After Transapical and Transfemoral Transcatheter Aortic Valve Insertion: An Evolving Experience. Ann Thorac Surg, 2016. 102(1): p. 56-61.
- D, Cohen., Transcarotid TAVR: the forgotter alternative. Trascateter and Vascular Therapeutics 2016, personal comunication, 2015
- Rajagopal, R., R.S. More, and D.H. Roberts, Transcatheter aortic valve implantation through a transcarotid approach under local anesthesia. Catheter Cardiovasc Interv, 2014. 84(6): p. 903-7.
- Mylotte, D., et al., Transcarotid Transcatheter Aortic Valve Replacement: Feasibility and Safety. JACC Cardiovasc Interv, 2016. 9(5): p. 472-80.
- Fusini, L., et al., Incidence and severity of atherosclerotic cardiovascular artery disease in patients undergoing TAVI. Int J Cardiovasc Imaging, 2015. 31(5): p. 975-85.
- D, C., Transcarotid TAVR: the forgotter alternative. Trascateter and Vascular Therapeutics 2016, personal comunication, 2015.
- Campelo-Parada, F., et al., A Novel Transcarotid Approach for Implantation of Balloon-Expandable or Self-Expandable Transcatheter Aortic Valves. Can J Cardiol, 2016.
- Tops, L.F., et al., Noninvasive evaluation of the aortic root with multislice computed tomography implications for transcatheter aortic valve replacement. JACC Cardiovasc Imaging, 2008. 1(3): p. 321-30.


