Tomografía coronaria para la planificación de intervenciones coronarias: TCI, bifurcaciones, reestenosis intrastent, injertos aorto-coronarios, otras lesiones
INTRODUCCION. ¿Por qué Angiografía Coronaria por Tomografía Computarizada para guiar procedimientos?
La Angiografía Coronaria por Tomografía Computarizada (ACTC) es una de las técnicas de imágenes de elección en el diagnóstico no invasivo de pacientes con sospecha de enfermedad arterial coronaria (EC). Las guías actuales, se centran en su elevado valor predictivo negativo para descartar EC y en su valor pronóstico para estratificar el riesgo cardiovascular y guiar el tratamiento médico (1,2). Además, como se tratará en otros capítulos, la ACTC permite realizar una evaluación funcional de las lesiones mediante el cálculo de la reserva fraccional de flujo (FFR) ayudando a identificar a los pacientes candidatos a intervenciones coronarias percutáneas (ICP).
Sin embargo, aunque el papel en el diagnóstico de la EC de la ACTC está bien establecido, su lugar en la planificación y guía de las ICP se está por determinar. El importante desarrollo de la ACTC en los últimos años, con la mejora de su resolución espacial, ha logrado que sea posible no sólo identificar la presencia de EC, sino clasificar la severidad de las lesiones; diferenciar los componentes de la placa y determinar con exactitud la longitud y el trayecto de las estenosis. Esto aporta información para la selección de los pacientes candidatos a angioplastia y para la planificación y posterior guía de los procedimientos. Pese a esto, en el campo de la ICP, al contrario de lo que ocurre en el intervencionismo valvular percutáneo, la mayoría de los pacientes llegan al laboratorio de hemodinámica sin un estudio detallado de la anatomía coronaria ni de las características de las lesiones y sin una estrategia terapéutica bien definida. Además, aunque el uso de técnicas de imagen intravascular como la tomografía de coherencia óptica (OCT) y el ultrasonido intravascular (IVUS) aportan información fundamental a este respecto pudiendo resolver muchas de las limitaciones de la angiografía, su penetrancia en el mundo real se estima por debajo del 10% (3,4) por razones que incluyen el consumo de tiempo y de recursos, así como la necesidad de experiencia por parte del operador para su adecuada interpretación.
Por ello, de acuerdo con el último documento de consenso emitido por la "Society of Cardiovascular Computed Tomography" (3), la incorporación de la ACTC en la planificación de las ICP podría mejorar la planificación y guía de la ICP. Esto sería mediante el uso de scores específicos basados en tomografía coronaria para decidir el mejor método de revascularización en pacientes multivaso o con anatomías complejas; la mejor caracterización de las lesiones para optimizar la estrategia terapéutica; la predicción del éxito en el tratamiento de las OTC (oclusiones totales crónicas) con scores derivados de la ACTC; o la identificación de lesiones coronarias subsidiarias de un abordaje específico (por ejemplo, lesiones calcificadas). Esto podría reducir la duración, la cantidad de contraste y la tasa de complicaciones de las angioplastias y mejorar los resultados.
La integración de la tomografía coronaria para la planificación de los procedimientos coronarios diferencia tres momentos: la evaluación diagnóstica de la anatomía y de las lesiones, la preparación del laboratorio de hemodinámica y la guía del procedimiento(5).
2. Evaluación diagnóstica: ¿Qué información aporta la Angiografía Coronaria por Tomografía Computarizada para guiar procedimientos?
La ACTC, por su elevada resolución espacial, permite realizar una evaluación anatómica no invasiva de las arterias coronarias que incluye la dimensión y el trayecto de los vasos, la longitud de las lesiones y las características de la placa. Esto es especialmente interesante en situaciones complejas como las lesiones de tronco coronario izquierdo, las OTC, las lesiones en bifurcaciones, la re-estenosis intra stent, los injertos aorto-coronarios o las anomalías coronarias(1,5,6). En estos escenarios, la ausencia de planificación previa a la revascularización puede llevar a una inadecuada selección de la estrategia terapéutica comprometiendo el resultado del procedimiento.
2.1 Evaluación de la lesión: luz y trayecto del vaso, longitud de la lesión y características de la placa.
La ACTC permite estimar la luz del vaso y optimizar la angioplastia planificando el diámetro del stent a implantar. Para ello, las dos medidas más importantes y que han demostrado la mayor correlación con la luz real, son el área luminal mínima y el diámetro del vaso de referencia (5,7). La primera define la severidad de la lesión y la segunda determina el diámetro del stent. Además, la capacidad de la ACTC de evaluar la anatomía coronaria en todo su trayecto permite medir con exactitud la longitud de la lesión para seleccionar la adecuada longitud del stent que garantice la cobertura completa de la lesión.
La ACTC permite definir cuantitativa y cualitativamente las características de la placa aterosclerótica y sus bordes con una buena correlación demostrada con el IVUS (8). Así, la ACTC determina el grado de calcificación de la placa cuantificando sus unidades Housfield (UH). A mayores UH, mayor es la cantidad de calcio, diferenciándose placas calcificadas, no calcificadas y mixtas (Figura 1, Figura 2). La ACTC es capaz de definir otras características que se han asociado a vulnerabilidad de la placa como el remodelado positivo o la baja atenuación (9). De hecho, existen trabajos que relacionan factores como la placa de baja atenuación o el resultado de la evaluación funcional de las lesiones con FFRTC como factores predictores de isquemia de las lesiones (10). Más concretamente, se ha definido la alta carga de placa de baja atenuación como predictor de eventos por encima de otros marcadores clásicos, como es el grado de estenosis de la lesión(11). A pesar de hacer falta trabajos específicos dirigidos a evaluarlo y, aunque la ACTC no se utiliza de rutina en la práctica clínica, esto podría tener implicaciones en la actitud diagnóstica favoreciendo, en lesiones con estas particularidades, completar el estudio durante el cateterismo mediante la medición del FFR invasivo incluso en casos de estenosis leve o moderada (12).
Figura 1. Reconstrucción multiplanar de ACTC mostrando la composición de la placa. De izquierda a derecha vemos una placa blanda, mixta y calcificada (flechas) (53).
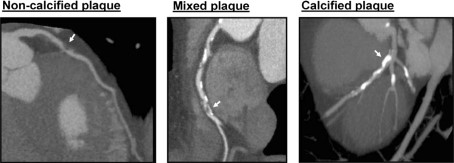
Figura 2. Análisis de la anatomía de la placa mediante ACTC. A la izquierda reconstrucción multiplanar de la LAD (Arteria Descendente Anterior), en la que se aprecia una reducción de calibre significativa (0,4 mm2) frente a área normal arterial (5 mm2), compatible con estenosis significativa. A la izquierda corte transversal de un vaso en que se ve una placa mixta, con densidad calcio y con densidad partes blandas, y el área permeable del vaso.
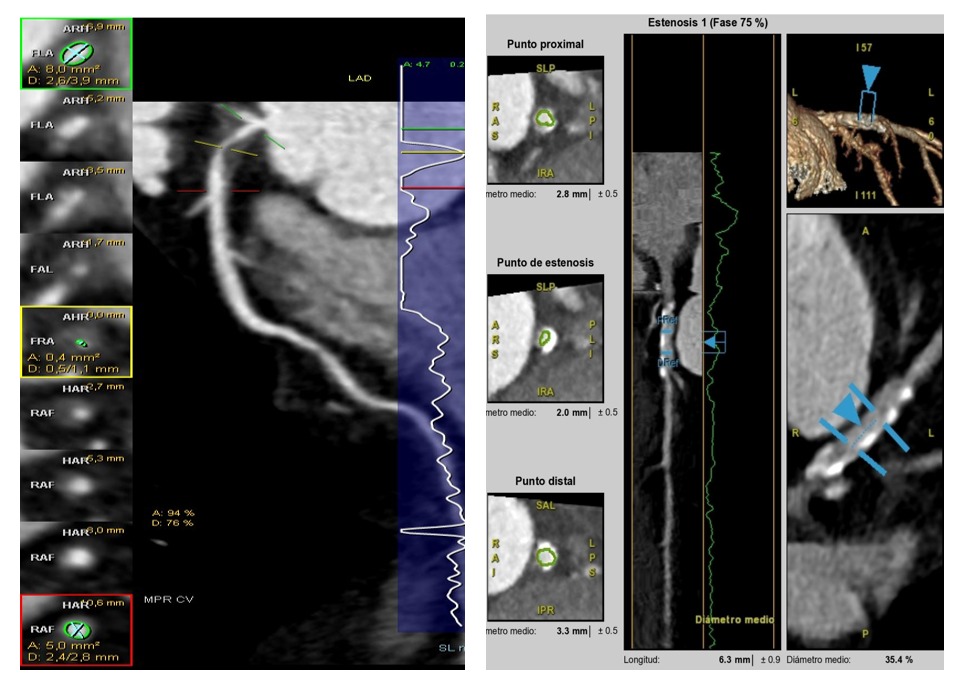
Existen softwares que integran toda esta información y realizan una reconstrucción del vaso en su totalidad y de la placa en particular. Sus componentes se codifican según un código de colores en función de sus UH siendo blanco para el calcio (>320 UH), verde para los entre 50-320 UH y rojo para las placas de baja atenuación (<50 UH). Esto facilita la evaluación de la extensión, volumen y composición de la placa.
La caracterización de la placa tiene, por un lado, implicaciones pronósticas al identificar a los pacientes con mayor riesgo de sufrir eventos coronarios peri y post ICP y, por otro lado, permite planificar la revascularización modificando la estrategia diagnóstica y terapéutica según los hallazgos. En cuanto a la modificación de la estrategia, datos recientes del estudio PARADIGM han demostrado la capacidad de la ACTC de identificar las placas con más riesgo de progresión donde el volumen de la placa de ateroma (PAV) ha resultado el mejor predictor de esto (13). Así, si bien hacen falta trabajos dirigidos a demostrarlo, la caracterización de la placa mediante ACTC podría tener papel en la planificación del seguimiento y decisión del momento de revascularización de los pacientes con EC.
En cuanto a la modificación de la estrategia terapéutica, las placas calcificadas tienen elevadas UH (>320). Dado que calcificación se asocia a infra expansión del stent y mayor tasa de eventos tras la angioplastia, conocer la anatomía de la placa y detectar de antemano lesiones calcificadas, permite prever la necesidad de utilizar técnicas de modificación de la placa durante la ICP. Por otro lado, las placas blandas (<50UH) son factor predictor independiente de síndrome coronario agudo, infarto peri-procedimiento y no reflow durante la angioplastia, lo cual también es relevante en la decisión sobre la indicación de la ICP y en la planificación de la intervención(11,14,15).
2.2 Tronco coronario
La enfermedad de tronco coronario izquierdo (TCI) es un factor independiente de mortalidad y morbilidad en la EAC, su correcta evaluación es fundamental en la toma de decisiones y la ACTC puede ser de interés dada la gran variabilidad descrita en la anatomía del TCI (Figura 3) (16). Además, diversos trabajos han reportado buena correlación entre el SYNTAX score calculado por ACTC y por angiografía en pacientes con enfermedad de TCI (17). Aunque hacen falta estudios dirigidos a su validación parece que el ACTC mejora la discriminación de pacientes con enfermedad de TCI mejor candidatos a ICP o a revascularización quirúrgica.
Figura 3. Reconstrucción multiplanar de ACTP que demuestra una placa blanda que ocluye completamente el TCI (Tronco Coronario Izquierdo). Este paciente había sido sometido a cirugía de revascularización coronaria y se aprecia en la imagen el empalme distal del bypass.
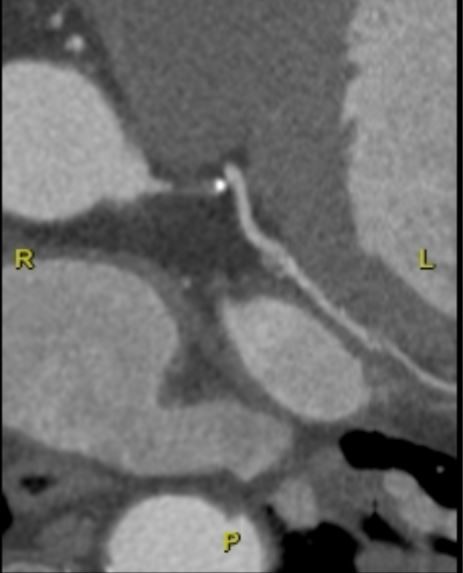
En estos escenarios complejos conocer la anatomía permite, además, informar al paciente de los riesgos específicos del procedimiento y de la eventual necesidad de soporte hemodinámico.
2.3 Bifurcaciones
La posibilidad de realizar una evaluación tridimensional de la anatomía coronaria mediante ACTC también es de gran interés en el abordaje de lesiones bifurcadas. En estos casos es de gran utilidad conocer la distribución de la placa en torno a la carina y valorar adecuadamente el vaso principal y las ramas secundarias para planificar la estrategia terapéutica a seguir (1,16).
Se ha propuesto, además, la posible utilidad de la ACTC para definir las proyecciones fluoroscópicas óptimas antes de la ICP en el abordaje de las bifurcaciones identificando los ángulos para la mejor visualización de los vasos (18,19). El objetivo sería el de reducir la cantidad de contraste y la exposición a radiación, así como también mejorar los resultados de los procedimientos al garantizar la cobertura completa de la lesión. Sin embargo, esto es sólo una hipótesis y hacen falta estudios para demostrarla y evaluar otros aspectos como el coste efectividad de implementar esta estrategia (20).
2.4 Oclusiones crónicas
Las OTC se definen como una estenosis coronaria del 100% con flujo distal TIMI 0 de 3 meses o más de evolución. Las OTC detectadas por ACTC se han asociado a bajo riesgo de eventos adversos cardiovasculares mayores en el seguimiento, mientras que la ICP o revascularización quirúrgica en este escenario no están libres de complicaciones y no han demostrado reducción de eventos. Por ello, las guías actuales sólo recomiendan el abordaje invasivo de las OTC para la mejora de la calidad de vida en pacientes sintomáticos (21). Así, es fundamental hacer un adecuado balance riesgo/beneficio para seleccionar a los pacientes que pueden beneficiarse de revascularización, así como para la decisión del abordaje quirúrgico o percutáneo.
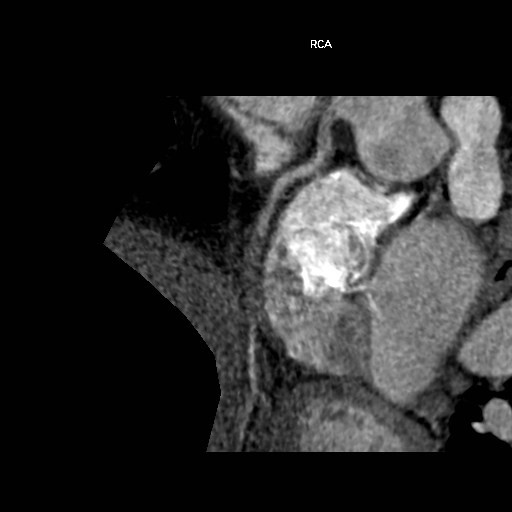
Con la angiografía convencional las arterias ocluidas se visualizan como un defecto de contraste mientras que, con la ACTC, se visualizan como un tejido blando sin paso de contraste (Figura 4). Esto permite localizar con precisión el origen de la oclusión y evaluar todo su trayecto superando algunas de las limitaciones de la angiografía en este escenario, como es la falta de relleno del vaso ocluido por las ramas colaterales (22). Además, la ACTC define variables de interés en la predicción del éxito de la ICP(23). Estas incluyen el grado de calcificación (50%) y su longitud (> 5.5 mm); la calcificación severa del muñón proximal y su morfología roma; la longitud de la oclusión (>15 mm, que se relaciona, además, con la duración del procedimiento (22)); el grado de angulación del vaso, el estrechamiento abrupto de éste o la tortuosidad (ángulo de > 45º en la trayectoria del vaso proximal o del segmento ocluido); la presencia de múltiples oclusiones; y las características de la circulación colateral (24,25).
Figura 4. Reconstrucción multiplanar de ACTC de la arteria CD (Coronaria Derecha), en que se precia una obstrucción total crónica en su 2ª porción.
Existen diversos scores dirigidos a optimizar la selección de pacientes con el objetivo de mejorar los resultados. El más utilizado, basado en criterios angiográficos, es el J-CTO (26), pero ya existen otros basados en la ACTC como el derivado del registro multicéntrico CT-RECTOR o del registro KCCT que han reportado mejor discriminación que el J-CTO en predicción del éxito del procedimiento y pronóstico posterior (27,28). Se ha publicado también un trabajo que compara la capacidad de predicción del éxito del procedimiento y cruce de la guía en los primeros 30 minutos con el J-CTO o con un score derivado basado en ACTC reportando mejor capacidad de discriminación con el segundo (29). Además, se ha publicado un ensayo clínico aleatorizado comparando la ICP en OTC con o sin ACTC previa donde se alcanza mayor tasa del éxito y menos complicaciones peri-procedimiento en el primer grupo (30).
Por tanto, en pacientes con OTC, existen datos que respaldan el papel de la ACTC en la selección de pacientes candidatos a tratamiento médico, revascularización quirúrgica o IPC. Además, en caso de optarse por ICP, la ACTC ayuda en la planificación del procedimiento, lo que es abordado en capítulo dedicado de este número por su particular interés del mundo intervencional. De forma dedicada y en sección separada en este número de Boletín se aborda la guía de intervención por IPC por técnicas de integración con ACTC y angiografía y su aplicación para facilitar el éxito de intervenir una OTC.
2.5 Injertos aorto-coronarios
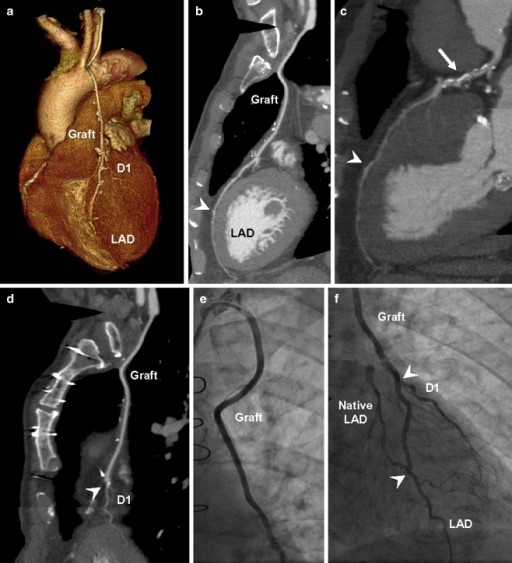
Los injertos de los pacientes sometidos a cirugía de revascularización son habitualmente venas o arterias de mayor calibre que las arterias coronarias y, además, son vasos menos susceptibles de artefactos por movimiento. Por ello, en estos pacientes la ACTC facilita la localización del origen, el trayecto y la terminación de los diferentes injertos (Figura 5) (31,32). Esto puede facilitar la decisión sobre la selección de catéteres y la técnica de canulación permitiendo, como ya se ha reportado en trabajos previos, disminuir la duración de la ICP y la cantidad de contraste empleada (33).
Figura 5: A) Reconstrucción tridimensional de la silueta cardiaca y trayectoria del injerto con anastomosis a la D1 (Primera diagonal ) y LAD (Arteria Descendente Anterior). B) Reconstrucción multiplanar de un injerto sano, la anastomosis con el vaso nativo se señala con la flecha. C) Reconstrucción multiplanar que muestra un injerto sano (cabeza de flecha) anastomosado a una LAD severamente enferma en su porción proximal (flecha). (54).
2.6 Re-estenosis intrastent
El tratamiento percutáneo se ha convertido en el principal método de revascularización en EC en los últimos años. Por ello, es frecuente tener que evaluar la anatomía coronaria en pacientes portadores de stents para descartar reestenosis de éstos o EC de novo (24,25). Si bien el uso de pruebas de imagen no invasivas se plantea interesante en este subgrupo de pacientes, la ACTC presenta limitaciones que hacen que no se recomiende, en general, su realización en pacientes portadores de stents. Esto es porque los stents metálicos generan artefactos que sobreestiman el tamaño de los struts infra estimando la luz arterial. Además, el artefacto inducido por la eventual calcificación concomitante puede imposibilitar la detección del propio stent. (34,35). Esto es más aparente en vasos de pequeño calibre y en pacientes sometidos a angioplastias complejas (<3 mm) (3,36) .
Con el avance tecnológico y la mejora de la resolución espacial de la ACTC estas limitaciones se han reducido existiendo ya trabajos que demuestran el valor pronóstico independiente de la cuantificación de la severidad de la EC en pacientes portadores de stents (37). Además, los nuevos stents metálicos tienen struts más finos que generan menos artefactos y existen trabajos con stents bio absorbibles que demuestran la posibilidad de obtener imágenes sin artefactos con este tipo de prótesis (38–40). Esto apoya el papel de la ACTC en la estratificación de riesgo de estos pacientes. En cualquier caso, las guías actuales solo recogen el uso de la ACTC en la evaluación de pacientes con sospecha de EC e ICP previa en caso de stents de > 3mm implantados en el TCI (41,42)
2.7 Otras lesiones: Fístulas, aneurismas y anomalías coronarias
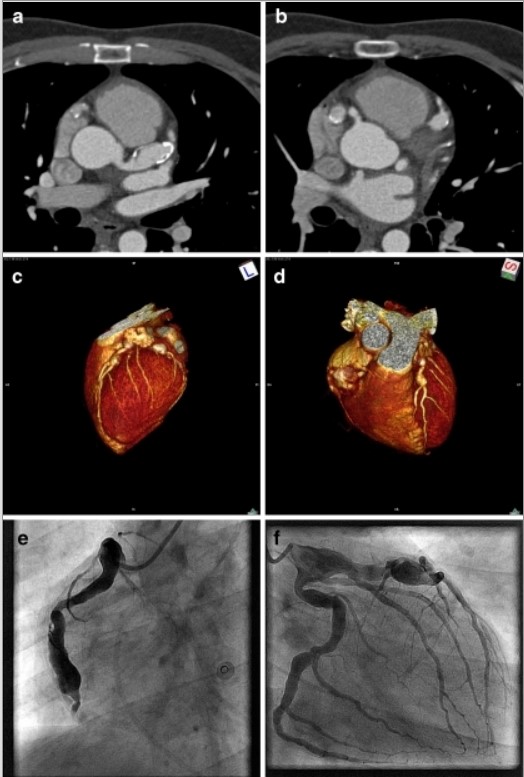
Los aneurismas de arterias coronarias se definen como la dilatación de una arteria coronaria 1.5 veces por encima del tamaño del vaso adyacente (Figura 6). Aunque la angiografía permite valorar la localización, forma, número y grado de aterosclerosis de éstos, la ACTC puede tener un papel añadido en su identificación y caracterización. De hecho, la prevalencia de aneurismas coronarios se ha reportado mayor con ACTC (hasta un 2.31%) que con angiografía (0.3-5%) en probable relación a su mayor resolución espacial (43). Además, esto ayuda a determinar con más precisión los detalles anatómicos del aneurisma y facilita la caracterización de la estenosis y composición de placa si existe. Además, el estasis de sangre generado en este tipo de anomalías, facilita la formación de trombo intraluminal. Esto es una limitación para la angiografía que supera la ACTP y que es de interés, junto con el resto de los aspectos comentados, para la planificación de una eventual ICP posterior (44).
Figura 6. a) Corte transversal por ACTC demostrando un aneurisma calcificado de la LAD; b) Corte transversal por ACTC de un aneurisma calcificado de la LAD y de la CD; c) Reconstrucción tridimensional de un aneurisma proximal de la arteria coronaria izquierda y de la Cx. D) Reconstrucción tridimensional por ACTC de un aneurisma de la arteria coronaria izquierda y de la arteria CD. e, f) Proyecciones angiográficas mostrando los aneurismas. LAD: Arteria Descendente Anterior; CD: Coronaria Derecha; Cx: Circunfleja. (55)
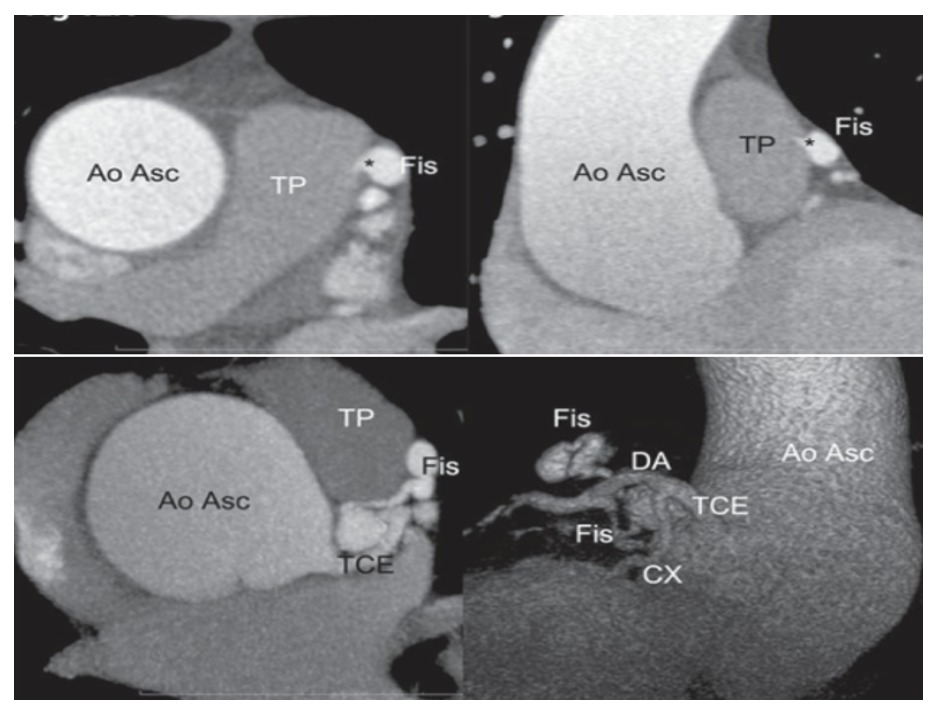
Las anomalías coronarias representan un defecto congénito consistente en una localización o morfología anormal del ostium de las coronarias o de su trayecto. Tienen una incidencia, variable según series, estimada en torno al 1% (45). Con el aumento de la realización de pruebas de imagen, su incidencia está también en aumento. La mayoría se consideran benignas y los pacientes permanecen asintomáticos, sin embargo, existen determinadas anatomías consideradas de alto riesgo por asociar riesgo de isquemia miocárdica, arritmias, insuficiencia cardiaca y muerte súbita (46). De hecho, existen series de autopsias que reportan esta condición como la segunda causa de muerte súbita en atletas jóvenes durante el esfuerzo sólo por detrás de la miocardiopatía hipertrófica (47). Las variantes de mayor riesgo incluyen las arterias con trayecto intraarterial, el ostium con morfología rasgada, la salida en ángulo agudo desde la aorta, el trayecto intramural, la morfología elíptica de la luz, o la hipoplasia de los vasos (Figura 7). La posibilidad de identificar y de caracterizar con detalle las anatomías de alto riesgo, e incluso realizar una evaluación funcional con pruebas de imagen no invasivas, puede ser de utilidad para la estratificación de riesgo y eventual planificación de intervenciones (6,48). Como los pacientes son habitualmente jóvenes, el diagnóstico de una anomalía coronaria no debería implicar sistemáticamente restricciones deportivas o procedimientos terapéuticos, sino que debería integrarse la información clínica, anatómica y funcional en la toma de decisiones. Por el perfil de estos pacientes y su baja tasa de eventos, no existen trabajos que evalúan utilidad de la ACTC. Hacen falta registros multicéntricos y estudios de seguimiento que aporten evidencia a las recomendaciones actuales. Las fístulas coronarias son comunicaciones anormales entre las arterias coronarias y otras partes de la circulación sistémica o pulmonar. La mayoría cursan de manera asintomática, pero en caso de shunt izquierda-derecha significativo, la clínica puede variar en severidad llegando a provocar insuficiencia cardiaca. En estos casos la adecuada identificación y valoración de las fístulas es clave para establecer la actitud diagnóstica y terapéutica. La ACTC tiene papel en la detección de fístulas coronarias (Figura 8). De hecho, existe discordancia entre la prevalencia reportada por angiografía, que oscila entre el 0.05-0.25%, y con ACTC, que llega al 0.9% (49). Además, la ACTC añade de manera no invasiva información detallada sobre su anatomía gracias a su elevada resolución espacial. Dado que este tipo de anomalías puede implicar numerosos puntos de origen y drenaje con anatomías complejas, esta información resulta esencial para la toma de decisiones y planificación de eventuales intervenciones (50).
Figura 7. A la izquierda, reconstrucción tridimensional por ACTC de un paciente con una anomalía coronaria consistente en un origen anómalo de la arteria CD desde seno izquierdo con trayecto inter arterial. A la derecha, otra reconstrucción de un paciente con una anomalía coronaria consistente en la presencia de dos vasos anómalos que conectan la CD con la D1 y LAD media. D1: Primera diagonal; LAD: Arteria Descendente Anterior; CD: Coronaria Derecha.
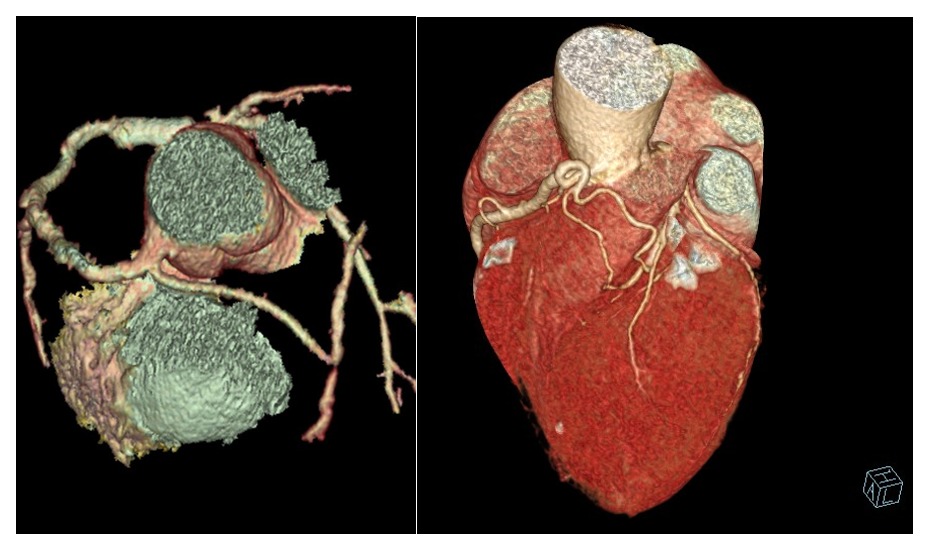
Figura 8. Diferentes proyecciones de estudio ACTC y reconstrucción tridimensional demostrando una fístula (Fis) comunicando la LAD con el TP. LAD: Arteria Descendente Anterior; TP: Tronco pulmonar; AoAsc: Aorta ascendente; TCE: Tronco coronario; Cx: circunfleja. (56)
3. Preparación del laboratorio de hemodinámica y guía del procedimiento: ¿Cómo implementar la Tomografía Coronaria al momento de la intervención?
El papel propuesto para la ACTC en el intervencionismo coronario incluye la planificación de la angioplastia y la guía durante el procedimiento.
En cuanto a la planificación, la capacidad de la ACTC de reconstruir tridimensionalmente el trayecto arterial coronario permite seleccionar la mejor proyección angiográfica para trabajar en el laboratorio de hemodinámica. Esto minimiza los problemas derivados de la imagen bidimensional de la angiografía, como son el acortamiento y solapamiento del segmento arterial de interés. Además, la planificación del procedimiento facilita la selección del tipo de catéteres y de la estrategia de canulación y facilita la localización de puntos de interés, como son el origen del injerto en pacientes revascularizados o el vaso distal y su trayecto en casos de OTC. En global, el conocimiento previo de las proyecciones y de la estrategia a seguir podría disminuir la cantidad de contraste, el tiempo y la radiación empleados durante la ICP. Todo ello, podría contribuir en la mejora del resultado de los procedimientos. En cualquier caso, esto es sólo una hipótesis que debe ser evaluada con estudios específicos y analizando otros aspectos como el coste- efectividad de la adopción de esta estrategia de planificación.
En cuanto a la guía durante el procedimiento, actualmente existen softwares que permiten visualizar las imágenes de ACTC en las pantallas del laboratorio de hemodinámica durante la ICP. Es posible incluso conectar el arco en C de la mesa de hemodinámica para sincronizar la orientación de la reconstrucción 3D del árbol coronario con la proyección fluoroscópica del brazo y guiar en vivo la angioplastia por ACTC (5).
4. Limitaciones actuales de la Angiografía Coronaria por Tomografía Computarizada
Las principales limitaciones de la ACTC incluyen el uso de radiación ionizante; la utilización de contraste; y los artefactos por calcio, metal o por movimiento.
La ACTC emplea radiación ionizante. Además, la cantidad de radiación determina la calidad de la imagen y determinadas condiciones del paciente como la obesidad disminuyen la calidad de los estudios, necesitando más radiación para lograr estudios de calidad.
Los estudios de ACTC se realizan con contrastes yodados hidrosolubles que no están exentos de efectos secundarios. Destaca su potencial nefrotoxicidad en forma de nefropatía inducida por contraste con una incidencia estimada del 0-5% en población con función renal normal, y hasta de un 30% en pacientes con alteración basal del filtrado glomerular. Para su prevención se recomienda el uso de contraste isoosmolar y la hidratación del paciente antes, durante y después del procedimiento (51,52). Aunque es menos frecuente, el contraste puede producir reacciones adversas que no contraindican su administración, pero implican la necesidad de administrar profilaxis con medicación.
La interpretación de las placas calcificadas requiere una consideración especial por generar artefactos que pueden sobreestimar el volumen de calcio y por la incapacidad de localizar el calcio en el vaso (superficial o profundo). Esto último tiene implicaciones terapéuticas porque la mayoría de las técnicas para la modificación de la placa lo hacen sobre el calcio superficial.
La ACTC también presenta limitaciones en pacientes portadores de stents. Éstos generan artefactos ("blooming effect") que producen un falso engrosamiento de los struts del stent pudiendo infraestimarse la luz arterial en mayor o menor medida según el tipo y tamaño del stent (35). Si bien con los nuevos stents y las mejoras tecnológicas han superado en parte estas limitaciones, hacen falta trabajos que demuestren la utilidad de la ACTC en la valoración de la EC en pacientes con ICP previa.
El artefacto por movimiento es otra de las limitaciones de la ACTC. Aunque con los nuevos avances técnicos el tiempo de apnea requerido para realizar el estudio es mínimo, se necesita que el paciente colabore para obtener imágenes de la calidad.
5. Perspectivas a futuro de la Angiografía Coronaria por Tomografía Computarizada.
El papel de la ACTC en el diagnóstico y estratificación de EC está bien establecido. Sin embargo, aunque las características de esta técnica la convierten en una potencial herramienta para la planificación y guía de la ICP, el impacto clínico de su uso todavía no se ha demostrado (41).
Dado que la ACTC es el método de elección en la evaluación no invasiva de la EC, es previsible un aumento en el número de pacientes derivados a coronariografía en base a los resultados de un estudio de ACTC. Esto podría facilitar la implementación de la ACTC en la práctica habitual para la planificación de la ICP con el objetivo no sólo de mejorar sus resultados, sino de optimizar la organización del personal y de las unidades de hemodinámica, mejorando el aprovechamiento de recursos (3). Se ha planteado también la posibilidad de utilizar la ACTC en la guía de las angioplastias mediante la integración de las imágenes en las pantallas de las salas de hemodinámica y la sincronización de los equipos de hemodinámica con los softwares de ACTC.
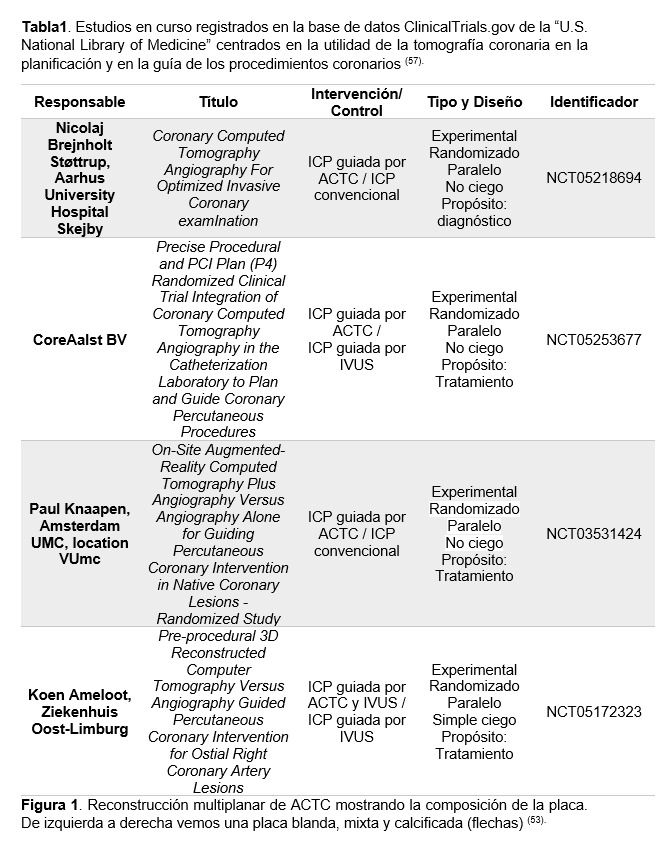
En la actualidad, existen estudios en marcha dedicados a demostrar la utilidad real de integrar la tomografía coronaria en la planificación y guía de los procedimientos coronarios (Tabla 1). Sus resultados, podrían revolucionar el abordaje actual de la EC.
Con la evidencia actual y el aumento de número de estudios de ACTC en casos con sospecha de EC, parece que la capacidad de interpretación de ACTC debería encontrarse entre las competencias básicas de todos los cardiólogos intervencionistas.
Bibliografía
- Tzimas G, Gulsin GS, Takagi H, Mileva N, Sonck J, Muller O, et al. Coronary CT Angiography to Guide Percutaneous Coronary Intervention. Vol. 4, Radiology: Cardiothoracic Imaging. Radiological Society of North America Inc.; 2022.
- Al-Mallah MH, Aljizeeri A, Villines TC, Srichai MB, Alsaileek A. Cardiac computed tomography in current cardiology guidelines. Vol. 9, Journal of Cardiovascular Computed Tomography. Elsevier Inc.; 2015. p. 514–23.
- Andreini D, Collet C, Leipsic J, Nieman K, Bittencurt M, de Mey J, et al. Pre-procedural planning of coronary revascularization by cardiac computed tomography. J Cardiovasc Comput Tomogr. 2022;
- Räber L, Mintz GS, Koskinas KC, Johnson TW, Holm NR, Onuma Y, et al. Clinical use of intracoronary imaging. Part 1: Guidance and optimization of coronary interventions. An expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J. 2018 Sep 14;39(35):3281–300.
- Collet C, Sonck J, Leipsic J, Monizzi G, Buytaert D, Kitslaar P, et al. Implementing Coronary Computed Tomography Angiography in the Catheterization Laboratory. Vol. 14, JACC: Cardiovascular Imaging. Elsevier Inc.; 2021. p. 1846–55.
- Gräni C, Buechel RR, Kaufmann PA, Kwong RY. Multimodality Imaging in Individuals With Anomalous Coronary Arteries. 2017.
- Collet C, Onuma Y, Grundeken M, Miyazaki Y, Bittercourt M, Kitslaar P, et al. In vitro validation of coronary CT angiography for the evaluation of complex lesions. EuroIntervention. 2018 Feb;13(15):e1823–30.
- Kiran Munnur R, Andrews J, Kataoka Y, Psaltis PJ, Nicholls SJ, Malaiapan Y, et al. Serial Coronary Plaque Assessment Using Computed Tomography Coronary Angiography: A Comparison With Intravascular Ultrasound. Circ Cardiovasc Imaging. 2019 Mar 1;12(3).
- Bartykowszki A, Celeng C, Károlyi M, Maurovich-Horvat P. High Risk Plaque Features on Coronary CT Angiography. Vol. 7, Current Cardiovascular Imaging Reports. Current Medicine Group LLC 1; 2014. p. 1–12.
- Gaur S, Altern Ovrehus K, Dey D, Leipsic J, Botker HE, Jensen JM, et al. Coronary plaque quantification and fractional flowreserve by coronary computed tomographyangiography identify ischaemia-causing lesions. Vol. 37, European Heart Journal. Oxford University Press; 2016. p. 1228–31.
- Williams MC, Kwiecinski J, Doris M, McElhinney P, D’Souza MS, Cadet S, et al. Low-Attenuation Noncalcified Plaque on Coronary Computed Tomography Angiography Predicts Myocardial Infarction: Results from the Multicenter SCOT-HEART Trial (Scottish Computed Tomography of the HEART). Circulation. 2020;1452–62.
- Gaur S, Øvrehus KA, Dey D, Leipsic J, Bøtker HE, Jensen JM, et al. Coronary plaque quantification and fractional flow reserve by coronary computed tomography angiography identify ischaemia-causing lesions. Eur Heart J. 2016 Apr 14;37(15):1220–7.
- Lee SE, Sung JM, Andreini D, Budoff MJ, Cademartiri F, Chinnaiyan K, et al. Differential association between the progression of coronary artery calcium score and coronary plaque volume progression according to statins: the Progression of AtheRosclerotic PlAque DetermIned by Computed TomoGraphic Angiography Imaging (PARADIGM) study. Eur Heart J Cardiovasc Imaging. 2019 Nov 1;20(11):1307–14.
- Motoyama S, Sarai M, Harigaya H, Anno H, Inoue K, Hara T, et al. Computed Tomographic Angiography Characteristics of Atherosclerotic Plaques Subsequently Resulting in Acute Coronary Syndrome. J Am Coll Cardiol. 2009 Jun 30;54(1):49–57.
- Uetani T, Amano T, Kunimura A, Kumagai S, Ando H, Yokoi K, et al. The Association Between Plaque Characterization by CT Angiography and Post-Procedural Myocardial Infarction in Patients With Elective Stent Implantation. 2010.
- Tu S, Jing J, Holm NR, Onsea K, Zhang T, Adriaenssens T, et al. In vivo assessment of bifurcation optimal viewing angles and bifurcation angles by three-dimensional (3D) quantitative coronary angiography. International Journal of Cardiovascular Imaging. 2012 Oct;28(7):1617–25.
- Pozo E, Álvarez-Acosta L, Alonso D, Pazos-Lopez P, de Siqueira MEM, Jacobi A, et al. Diagnostic accuracy of coronary ct for the quantification of the syntax score in patients with left main and/or 3-vessel coronary disease. Comparison with invasive angiography. Int J Cardiol. 2015 Mar 1;182:549–56.
- Garcia JA, Movassaghi B, Casserly IP, Klein AJ, James Chen SY, Messenger JC, et al. Determination of optimal viewing regions for X-ray coronary angiography based on a quantitative analysis of 3D reconstructed models. International Journal of Cardiovascular Imaging. 2009;25(5):455–62.
- Gollapudi RR, Valencia R, Lee SS, Wong GB, Teirstein PS, Price MJ. Utility of three-dimensional reconstruction of coronary angiography to guide percutaneous coronary intervention. Catheterization and Cardiovascular Interventions. 2007 Mar 1;69(4):479–82.
- Kočka V, Thériault-Lauzier P, Xiong TY, Ben-Shoshan J, Petr R, Laboš M, et al. Optimal Fluoroscopic Projections of Coronary Ostia and Bifurcations Defined by Computed Tomographic Coronary Angiography. JACC Cardiovasc Interv. 2020 Nov 9;13(21):2560–70.
- Elias J, van Dongen IM, Råmunddal T, Laanmets P, Eriksen E, Meuwissen M, et al. Long-term impact of chronic total occlusion recanalisation in patients with ST-elevation myocardial infarction. Heart. 2018 Sep;104(17):1432–8.
- Li P, Gai LY, Yang X, Sun ZJ, Jin QH. Computed tomography angiography-guided percutaneous coronary intervention in chronic total occlusion. J Zhejiang Univ Sci B. 2010 Aug;11(8):568–74.
- Luo C, Huang M, Li J, Liang C, Zhang Q, Liu H, et al. Predictors of Interventional Success of Antegrade PCI for CTO. JACC Cardiovasc Imaging. 2015 Jul;8(7):804–13.
- Opolski MP, Achenbach S, Schuhbäck A, Rolf A, Möllmann H, Nef H, et al. Coronary computed tomographic prediction rule for time-efficient guidewire crossing through chronic total occlusion: Insights from the CT-RECTOR multicenter registry (computed tomography registry of chronic total occlusion revascularization). JACC Cardiovasc Interv. 2015 Feb 1;8(2):257–67.
- Mollet NR, Hoye A, Lemos PA, Cademartiri F, Sianos G, McFadden EP, et al. Value of preprocedure multislice computed tomographic coronary angiography to predict the outcome of percutaneous recanalization of chronic total occlusions. American Journal of Cardiology. 2005 Jan 15;95(2):240–3.
- Christopoulos G, Wyman RM, Alaswad K, Karmpaliotis D, Lombardi W, Grantham JA, et al. Clinical Utility of the Japan–Chronic Total Occlusion Score in Coronary Chronic Total Occlusion Interventions. Circ Cardiovasc Interv. 2015 Jul;8(7).
- Opolski MP, Achenbach S, Schuhbäck A, Rolf A, Möllmann H, Nef H, et al. Coronary Computed Tomographic Prediction Rule for Time-Efficient Guidewire Crossing Through Chronic Total Occlusion. JACC Cardiovasc Interv. 2015 Feb;8(2):257–67.
- Yu CW, Lee HJ, Suh J, Lee NH, Park SM, Park TK, et al. Coronary Computed Tomography Angiography Predicts Guidewire Crossing and Success of Percutaneous Intervention for Chronic Total Occlusion. Circ Cardiovasc Imaging. 2017 Apr;10(4).
- Fujino A, Otsuji S, Hasegawa K, Arita T, Takiuchi S, Fujii K, et al. Accuracy of J-CTO Score Derived From Computed Tomography Versus Angiography to Predict Successful Percutaneous Coronary Intervention. JACC Cardiovasc Imaging. 2018 Feb;11(2):209–17.
- Hong SJ, Kim BK, Cho I, Kim HY, Rha SW, Lee SH, et al. Effect of Coronary CTA on Chronic Total Occlusion Percutaneous Coronary Intervention. JACC Cardiovasc Imaging. 2021 Oct;14(10):1993–2004.
- Meyer TS, Martinoff S, Hadamitzky M, Will A, Kastrati A, Schömig A, et al. Improved Noninvasive Assessment of Coronary Artery Bypass Grafts With 64-Slice Computed Tomographic Angiography in an Unselected Patient Population. J Am Coll Cardiol. 2007 Mar 6;49(9):946–50.
- Ohtsuka T, Akahane M, Ohtomo K, Kotsuka Y, Takamoto S. Three-Dimensional Computed Tomography for Reoperative Minimally Invasive Coronary Artery Bypass. Vol. 70, Ann Thorac Surg. 2000.
- Jones DA, Castle E v., Beirne AM, Rathod KS, Treibel TA, Guttmann OP, et al. Computed tomography cardiac angiography for planning invasive angiographic procedures in patients with previous coronary artery bypass grafting. EuroIntervention. 2020 Feb;15(15):e1351–7.
- Sigovan M, Si-Mohamed S, Bar-Ness D, Mitchell J, Langlois JB, Coulon P, et al. Feasibility of improving vascular imaging in the presence of metallic stents using spectral photon counting CT and K-edge imaging. Sci Rep. 2019 Dec 1;9(1).
- Mahnken AH. CT Imaging of Coronary Stents: Past, Present, and Future. ISRN Cardiol. 2012 Sep 11;2012:1–12.
- Sanz-Sánchez J, Chiarito M, Gill GS, van der Heijden LC, Piña Y, Cortese B, et al. Small Vessel Coronary Artery Disease: Rationale for Standardized Definition and Critical Appraisal of the Literature. Journal of the Society for Cardiovascular Angiography & Interventions. 2022 Sep;1(5):100403.
- Hossain A, Small G, Crean AM, Jones R, Yam Y, Bishop H, et al. Prognostic value of coronary computed tomography angiography in patients with prior percutaneous coronary intervention. J Cardiovasc Comput Tomogr. 2021 May 1;15(3):268–73.
- Collet C, Chevalier B, Cequier A, Fajadet J, Dominici M, Helqvist S, et al. Diagnostic Accuracy of Coronary CT Angiography for the Evaluation of Bioresorbable Vascular Scaffolds. JACC Cardiovasc Imaging. 2018 May 1;11(5):722–32.
- Gao R, Yang Y, Han Y, Huo Y, Chen J, Yu B, et al. Bioresorbable Vascular Scaffolds Versus Metallic Stents in Patients With Coronary Artery Disease ABSORB China Trial. 2015.
- Ferenț I, Mester A, Chițu M, Benedek A, Rațiu M, Hodas R, et al. CTA Evaluation of Bioresorbable Scaffolds versus Metallic Coronary Stents – a Feasibility Study. Journal of Interdisciplinary Medicine. 2018 Sep 1;3(3):152–9.
- Taylor AJ, Cerqueira M, Hodgson JMB, Mark D, Min J, O’Gara P, et al. ACCF/SCCT/ACR/AHA/ASE/ASNC/NASCI/SCAI/SCMR 2010 appropriate use criteria for cardiac computed tomography. Vol. 56, Journal of the American College of Cardiology. Elsevier USA; 2010. p. 1864–94.
- Jubran A, Willemink MJ, Nieman K. Coronary CT in Patients with a History of PCI or CABG: Helpful or Harmful? Vol. 12, Current Cardiovascular Imaging Reports. Current Medicine Group LLC 1; 2019.
- Forte E, Aiello M, Inglese M, Infante T, Soricelli A, Tedeschi C, et al. Coronary artery aneurysms detected by computed tomography coronary angiography. Eur Heart J Cardiovasc Imaging. 2017 Nov 1;18(11):1229–35.
- Díaz-Zamudio M, Bacilio-Pérez U, Herrera-Zarza MC, Meave-González A, Alexanderson-Rosas E, Zambrana-Balta GF, et al. Coronary artery aneurysms and ectasia: Role of coronary CT angiography. Radiographics. 2009 Nov;29(7):1939–54.
- Lorenz EC, Mookadam F, Mookadam M, Moustafa S, Zehr KJ. A Systematic Overview of Anomalous Coronary Anatomy and an Examination of the Association With Sudden Cardiac Death [Internet]. Vol. 7, Rev Cardiovasc Med. 2006. Available from: www.medreviews.com
- Gentile F, Castiglione V, de Caterina R. Coronary Artery Anomalies. Circulation. Lippincott Williams and Wilkins; 2021. p. 983–96.
- Maron BJ, Haas TS, Ahluwalia A, Murphy CJ, Garberich RF. Demographics and Epidemiology of Sudden Deaths in Young Competitive Athletes: From the United States National Registry. American Journal of Medicine. 2016 Nov 1;129(11):1170–7.
- Gräni C, Benz DC, Schmied C, Vontobel J, Possner M, Clerc OF, et al. Prevalence and characteristics of coronary artery anomalies detected by coronary computed tomography angiography in 5 634 consecutive patients in a single centre in Switzerland. Swiss Med Wkly. 2016;146:w14294.
- Lim JJ, Jung JI, Lee BY, Lee HG. Prevalence and types of coronary artery fistulas detected with coronary CT angiography. American Journal of Roentgenology. 2014 Sep 1;202(3):W237–43.
- Yun G, Nam TH, Chun EJ. Coronary artery fistulas: Pathophysiology, imaging findings, and management. Radiographics. 2018 May 1;38(3):688–703.
- O’Brien F. Nefropatía por contraste. https://www.msdmanuals.com/es-es/professional/trastornos-urogenitales/enfermedades-tubulointersticiales/nefropat%C3%ADa-por-contraste.
- Davenport MS, Perazella MA, Yee J, Dillman JR, Fine D, McDonald RJ, et al. Use of intravenous iodinated contrast media in patients with kidney disease: Consensus statements from the American College of Radiology and the National Kidney Foundation. Radiology. 2020;294(2):660–8.
- van Werkhoven JM, Bax JJ, Nucifora G, Jukema JW, Kroft LJ, de Roos A, et al. The value of multi-slice-computed tomography coronary angiography for risk stratification. Journal of Nuclear Cardiology [Internet]. 2009 Dec 18 [cited 2022 Dec 6];16(6):970–80. Available from: https://openi.nlm.nih.gov/detailedresult?img=PMC2776172_12350_2009_9144_Fig3_HTML&query=The%20value%20of%20multi-slice-computed%20tomography%20coronary%20angiography%20for%20risk%20stratification.&it=xg&req=4&npos=1
- de Graaf FR, van Velzen JE, Witkowska AJ, Schuijf JD, van der Bijl N, Kroft LJ, et al. Diagnostic performance of 320-slice multidetector computed tomography coronary angiography in patients after coronary artery bypass grafting. Eur Radiol [Internet]. 2011 Nov 7 [cited 2022 Dec 6];21(11):2285–96. Available from: https://openi.nlm.nih.gov/detailedresult?img=PMC3184392_330_2011_2192_Fig3_HTML&query=Diagnostic%20performance%20of%20320-slice%20multidetector%20computed%20tomography%20coronary%20angiography%20in%20patients%20after%20coronary%20artery%20bypass%20grafting&it=xg&req=4&npos=3
- van Beek LM, Luijten H. Giant coronary aneurysms: three-dimensional reconstruction. Netherlands Heart Journal [Internet]. 2012 Jan 24 [cited 2022 Dec 6];20(1):42–3. Available from: https://openi.nlm.nih.gov/detailedresult?img=PMC3247630_12471_2011_150_Fig1_HTML&query=Giant%20coronary%20aneurysms:%20three-dimensional%20reconstruction.&it=xg&req=4&npos=1
- Neves PO, Andrade J, Monção H. Coronary anomalies: what the radiologist should know. Radiol Bras [Internet]. 2015 [cited 2022 Dec 6];48(4):233–41. Available from: https://openi.nlm.nih.gov/detailedresult?img=PMC4567362_rb-48-04-0233-g12&query=coronary%20anomalies:%20what%20the%20radiologist%20should%20know&it=xg&req=4&npos=8
- U.S. National Library of Medicine. ClinicalTrials.gov [Internet]. [cited 2022 Dec 6]. Available from: https://clinicaltrials.gov/




