Evalucación Y Tratamiento de Bifurcación con Fisiología E Imagenología Intracoronaria
La angiografía coronaria es el método tradicionalmente más usado para la clasificación, evaluación y tratamiento de una lesión en bifurcación. Sin embargo, numerosos estudios han reforzado las limitaciones de este enfrentamiento. El desarrollo de técnicas de evaluación fisiológica y de imagenología intracoronaria (ultrasonido intracoronario -IVUS- y tomografía de coherencia óptica intracoronaria -OCT-) han mejorado el entendimiento y los resultados de nuestros tratamientos, considerándose hoy en día herramientas necesarias, en particular en tratamientos de bifurcaciones complejas y en el tratamiento de la bifurcación del tronco coronario izquierdo(1,2,14,18).
A continuación desarrollaremos las ventajas y algunas consideraciones técnicas del uso de estas herramientas complementarias en el manejo de una bifurcación coronaria
_
Evaluación Fisiológica Intracoronaria
El uso de la reserva de flujo fraccional (FFR) y más recientemente el índice medido en el período libre de ondas (iFR -instantaneous wave-free ratio) permiten evaluar la significancia hemodinámica de una estenosis coronaria. En diversos estudios (FAME, FAME 2, DEFINE-FLAIR and IFR-SWEDEHEART) la presencia de una estenosis no significativa (FFR > 0,8 e iFR > 0.93) ha demostrado ser un escenario de buen pronóstico sin intervención coronaria con una baja tasa de eventos adversos. Asimismo, el realizar angioplastía guiada por FFR vs. angiografía mejora los eventos adversos en el seguimiento y permite el uso racional de stents coronarios, en particular en presencia de enfermedad multivaso(1,2,6,7,8,9).
Estudios de caso-control han mostrado que el uso de FFR resulta en una menor intervención sobre la rama lateral con eventos clínicos comparables en contexto de una técnica provisonal. Chen et al (DKCRUSH IV) se presenta como el primer estudio randomizado comparando la intervención sobre la rama lateral guiado por fisiología coronaria versus angiografía en contexto de bifurcaciones verdaderas con técnica provisional, requiriendo un menor necesidad de implante de stent en la RL (25,9% vs. 38,1%). Los eventos combinados a un año (muerte cardíaca, infarto de miocardio, necesidad clínica de nueva revascularización sobre arteria tratada) fueron similares en ambos grupos y sin diferencia en trombosis de stent o necesidad de nueva revascularización, sin embargo con mayor porcentaje de reetenosis en la rama princial distal a la bifurcación. Esto difiere de los resultados encontrados en estudios como el FAME, por lo que la estrategia de tratamiento de la bifurcación sigue siendo aún controversial(1,2,3).
La siguiente tabla resume los momentos en los cuales, el uso de FFR-iFR es útil o no es recomendado
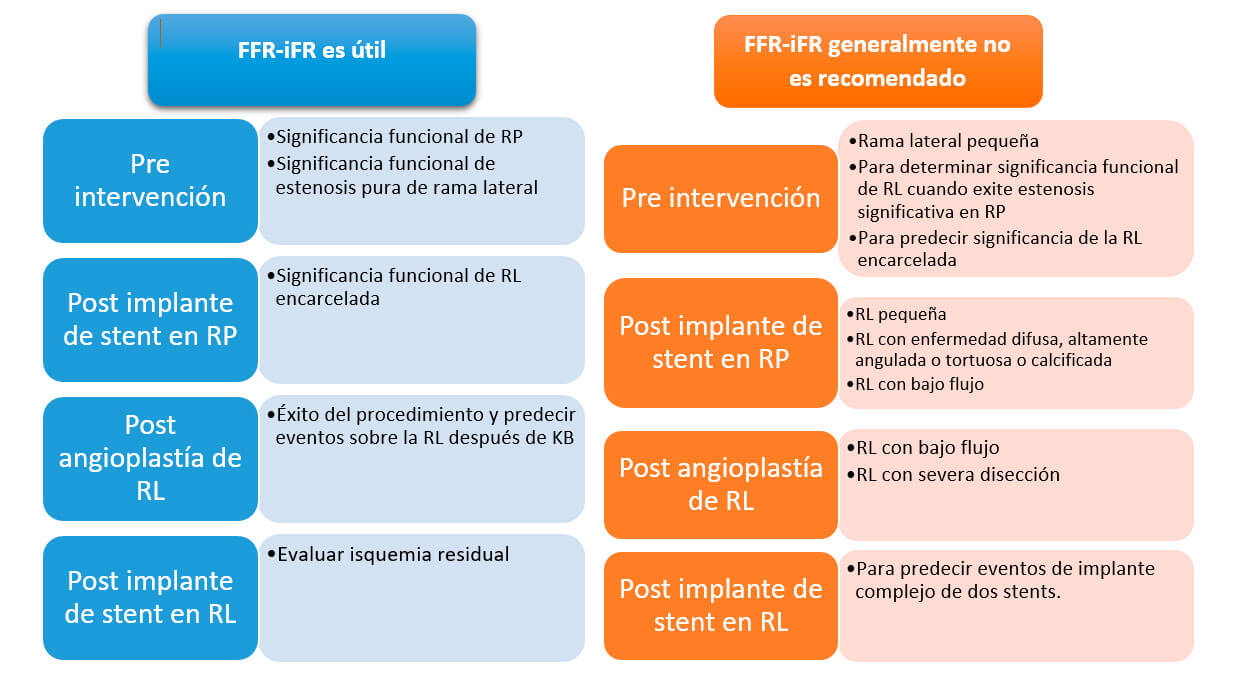
Referencias: (RP) ramo principal; (RL) ramo lateral; (KB) kissing balloon; Adaptado. Lee et al. Coronay fractional flow reserve in bifurcation stenoses: what have we learned?.
Eurointervention 2015;11:V59-V63.
_
Algunas consideraciones del uso de FFR-iFR en bifurcaciones
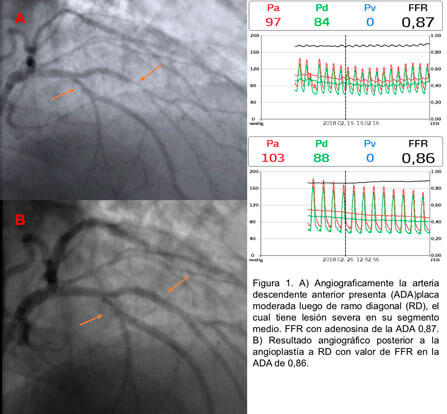
- Permite una caracterización fisiológica, lo que autoriza a reclasificar una bifurcación según su significancia hemodinámica. Lo anterior permite cambiar la estrategia terapéutica. (Figura 1)
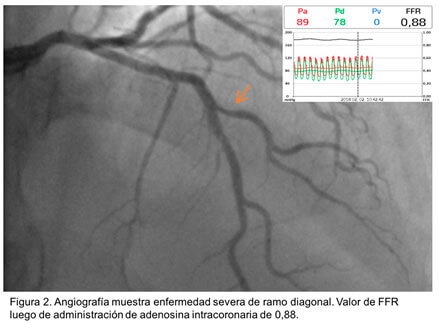
- En bifurcaciones con estenosis del ostium de la rama lateral o secundaria (RL) permite precisar la necesidad de tratamientos, dado la poca correlación entre estenosis angiográfica e isquemia en este contexto. (Figura 2)
- Post implante de stent es frecuente de ver un pinzamiento del ostium de la RL explicable en la mayoría de los casos por desplazamiento de la carina. El uso de FFR ha demostrado que gran parte de estas estenosis no son fisiológicamente importantes, hecho que se explica por un cambio en la geometría del ostium (tipo ojal) lo que produce un artefacto angiográfico. La evidencia sugiere que incluso en bifurcaciones de tronco la necesidad de dilatación o stent en estenosis ostiales con FFR > 0,8 post implante de stent en la rama principal (RP) no sería necesaria y que es seguro diferir la intervención, simplificando nuestras estrategias y evitando intervenciones no siempre necesarias de la RL.
- La evaluación fisiológica post implante de stent o kissing es predictor de eventos futuros y permite diagnosticar significancia hemodinámica residual
_
Algunos tips para un correcto análisis de una bifurcación por fisiología intracoronaria
- La medición debe realizarse con catéter guía. Use nitroglicerina intracoronaria previa (prevención espasmo coronario).
- La posibilidad de complicaciones es muy baja con el uso de FFR. Sin embargo, se desaconseja su uso en ramas con estenosis largas con importante angulación y calcificación.
- Para una óptima hiperemia si elige realizar FFR idealmente use adenosina en infusión (140 µg/kg/min). Adenosina intracoronaria es opción si no hago pullback. Nitroprusiato 100 ug intracoronario, hemos utilizado en algunos casos con buena correlación con adenosina y permitiendo realizar curva de retiro. El coregistro con angiografía, actualmente disponible, es de gran ayuda para correlacionar anatomía y funcionalidad (pullback iFR o FFR).
- Debe siempre realizarse una evaluación fisiológica de ambas ramas.
- Considerar todas las lesiones existentes. La evaluación fisiológica en una estenosis Medina 1,0,0/ 0,1,0/ 0,0,1 o 1,1,0 es recomendada y confiable. En presencia de un estenosis de la RP, el estudio de una estenosis de la RL en lesiones Medina 1,0 1 o 1,1,1 es menos preciso y no aconsejado.
- La presencia de estenosis proximal a una lesión bifurcación debe considerarse como un potencial factor de falso positivo de FFR de la estenosis de bifurcación interrogada. El uso de FFR con infusión de adenosina permite realizar un pullback y así acercarse a la significancia de cada una de las estenosis. iFR pullback es una opción atractiva porque además permite predecir el resultado fisiológico del implante de un stent. Siempre descarte en el pullback la presencia de damping (obstrucción al flujo ocasionado por el catéter) y de drift (fuga perdida de presión por perdida de estanqueidad del circuito de presión).
- En la evaluación de una estenosis de bifurcación de tronco, la presencia de estenosis severa en ADA proximal o CX proximal podría subestimar la significancia hemodinámica de una estenosis de bifurcación de la otra rama al “redirigir” parte del flujo. Es necesario repetir la evaluación fisiológica de ambas ramas una vez tratada la lesión severa distal a la bifurcación, observándose en ciertos casos, que un resultado de FFR no significativo limítrofe se transforma en significativo (10,11,12).
- No se recomienda usar la guía de presión como jailed wire, por lo que de preferencia es mejor recruzar con la guía de presión. El uso de microcatéteres de FFR (Navvus Acist) podría facilitar la evaluación de un tratamiento con stent provisional posterior al recruce de las guías de angioplastía tradicional en casos complejos. Asímismo, no está recomendado su uso en caso de flujo lento post implante de stent en la RL.
- Sugerimos que la decisión de realizar kissing balloon o stent en la RL no siempre debe basarse en un resultado de FFR aislado, pese a la evidencia inicial que favorece esta práctica. El contexto del paciente, la importancia de la rama y la presencia de estenosis distal a la rama que podría requerir intervención posterior son factores a considerar.
- La relevancia clínica de una rama lateral en contexto de una bifurcación pasa principalmente por la extensión de miocardio comprometido más que solo por la presencia de una cifra de FFR (13). Según el trabajo de Koo et al, al realizar el test de oclusión de un minuto de puede conocer el rol potencialmente “maligno” de la RL al identificar la presencia de isquemia por angina y cambios al ECG (2,5).
_
EVALUACIÓN ANATÓMICA. Ultrasonido intracoronario (IVUS) y tomografía de coherencia óptica (OCT)
Existe una amplia evidencia sobre el uso de IVUS en la evaluación y manejo de la bifurcación, y menos datos sobre el uso de OCT. La selección de una u otra técnica dependerá de factores del paciente, experiencia del operador y el tipo de vaso a interrogar. La presencia de insuficiencia renal, vasos grandes y lesiones aorto ostiales favorecen el uso de IVUS.
_
Las ventajas del uso de imagenología en tratamiento de bifurcación son
1) IVUS y OCT permite caracterizar en detalle la placa de la bifurcación, observándose casi en la totalidad de los casos que la ateroesclerosis respeta la carina. Además permite una correcta caracterización del ostium y segmento proximal de la rama lateral superior a la angiografía. La presencia de calcificación y su cuantificación es relevante también. Esta información posibilita un cambio de conducta en un porcentaje importante de casos (OCT > IVUS). Recuerde eso sí que no es un buen método para evaluar significancia funcional en la mayoría de los pacientes(14,17).
2) El análisis del ostium de la RL por IVUS (MLA, plaque burden y angulación) puede darnos información importante para nuestra estrategia pero no siempre es un predictor preciso del compromiso de la rama lateral post stent (15-16).
3) OCT permite una mejor caracterización del ostium de la RL desde el pullback de la rama principal pre y post implante de stent.
4) Es posible reconocer en un porcentaje importante de casos la presencia de remodelación negativa a nivel de ostium de la rama lateral.
5) La correcta dimensión de los diámetros proximal y en especial del diámetro de referencia distal de la RP permiten la correcta selección del stent a utilizar, eligiendo el diámetro de referencia distal en todos los casos para minimizar el riesgo de desplazamiento de la carina y estenosis o pérdida de la RL. Además permite realizar en forma exacta la técnica de optimización proximal (POT) con el diámetro de balón 1:1 al segmento proximal. (IVUS=OCT). Se ha evidenciado un mejor resultado en el área del stent final al utilizar IVUS u OCT vs angiografía.
6) La presencia de una placa lipídica concéntrica vulnerable o la alta carga trombótica en un cuadro agudo se asocia a embolización distal y posible fenómeno de no reflow o prolapso de placa-trombo intrastent, en especial si se realiza postdilatación agresiva como suele utilizarse en bifurcaciones complejas en ambas ramas. (OCT > IVUS).
7) Permite post implante de stent y en forma muy significativa en relación a angiografía el reconocimiento de disecciones residuales, mala posición y mala expansión del stent o la presencia de prolapsos de trombo o placa, hallazgos que se asocian a eventos adversos por lo que su reconocimiento pudiese mejorar el resultado clínico. (OCT >IVUS)(19).
8) Se han definido en la bifurcación de tronco áreas mínimas de un resultado adecuado post implante de stent. Esta meta se asocia a menores eventos adversos a futuro (IVUS >OCT en ostium y en vasos de más de 6 mm)(16,21).
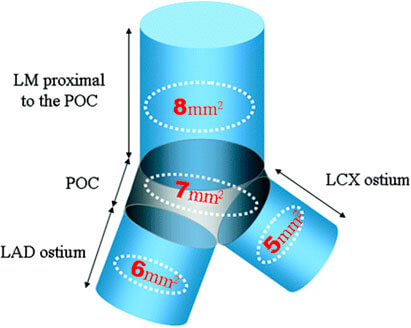
Figura 3. Valores mínimos de área del stent para la predicción de reestenosis angiográfica. LM: tronco coronario izquierdio; POC: poligono de confluencia; LAD: arteria descendente anterior; LCX: arteria circunfleja. Circ Cardiovasc Interv. 2011;4:562-569.
9) En presencia de un compromiso anatómico y funcional significativo de la RL, la caracterización entre placa vs desplazamiento de carina puede dirigir el tratamiento (placa: dilataciones más agresivas, alta chance de stent, mayor pérdida tardía vs desplazamiento de la carina: dilataciones con balones pequeños a baja presión, menos late loss y menos chance de stent).
10)El uso (en particular de IVUS) en evaluación del resultado en técnicas complejas de 2 stents se asocia a mejor pronóstico y menos eventos adversos (14,15,17).
11) Un paso esencial en la técnica de stent provisional es el correcto recruce de la guía por el strut más distal. Este punto es evaluable con técnicas de OCT y reconstrucción 3D en forma efectiva logrando post kissing un buen scaffolding de los struts hacia el ostium de la RL, evitando la deformidad del stent. También con la reconstrucción 3D es posible ver posterior al POT la relación entre los struts del stent y el ostium dela RL, para así en algunos casos no realizar dilataciones de ésta si no hay struts en la mitad del ostium. En casos de dificultad de avance de balón a rama lateral OCT permite visualizar la causa y corregirla (guía abluminal por ejemplo)(18,20).
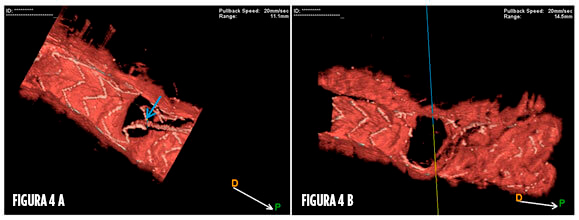
Figura 4.
A) Recruce de guía utilizando OCT con reconstruccion 3D.
B) Resultado de cruce por strut distal tras dilatación permite un amplio lumen y buen scaffolding hacia RL.
_
Consideraciones técnicas en imagenología
- Usar siempre nitroglicerina intracoronaria previo al avance de los catéteres de imágenes.
- Para OCT se aconseja la utilización de un catéter guía con adecuada posición para una buena inyección de contraste minimizando artefactos de flujo.
- Idealmente obtenga información de ambas ramas. En OCT se puede obtener visualización del ostium de la RL desde el pullback de la rama principal y realizar reconstrucción 3D. En caso de artefacto de sombra, movilíce la guía para su corrección.
- Si realiza pullback de la RL asegure que se visualiza el segmento proximal de la bifurcación.
- Se desaconseja IVUS u OCT en una RL enjaulada (riesgo de deformar stent).
- En tronco común prefiera IVUS para interrogar ostium y OCT para la bif. Para OCT aumente el rango de scan, minimice la velocidad de pullback y eventualmente aumente la dosis de contraste o el tamaño del catéter. El uso de extensores de catéter puede mejorar la calidad de la imagen.
- La utilización de co-registro angiografía-OCT o IVUS facilita la interpretación de los hallazgos y mejora la cobertura de la placa al tratar con stent.
- Para el sizing del dispositivo considere, en lo posible, el diámetro del vaso (lamina elástica externa) y no el lumen.
- Estandarizar los informes y las mediciones a realizar es fundamental.
_
Dr. César Vargas Ayancán
Fellow Cardiología Intervencional
Hospital San Juan de Dios, Santiago, Chile
Dr. Pablo Ramírez Escudero
Staff Cardiología Intervencional
Hospital San Juan de Dios, Santiago, Chile
Dr. Mario Araya Hormazábal
Staff Cardiología Intervencional
Hospital San Juan de Dios y Clínica Alemana
Director Jornadas SOLACI
_
Bibliografía
- Lee J, Koo B, Kumsars I, Curzen N, et al. Coronary fractional flow reserve in bifurcation stenoses: what have we learned?.Eurointervention 2015;11:V59-V63.
- Koo B. Fractional flow reserve for coronary bifurcation lesions. J Am CollCardiolIntv 2015;8:547-9.
- Chen S-L, Ye F, Zhang J-J, et al. Randomized comparison of FFR-guided and angiography-guided provisional stenting of true coronary bifurcations lesions: the DKCRUSH VI. J Am CollCardiolIntv 2015;8:536-46.
- Koo BK, Park KW, Kang HJ, et al. Physiologycal evaluation of the provisional side-branch intervention strategy for bifurcation lesion using fractional flow reserve. EurHeart 2008;29:726-32.
- Koo BK, Lee SP, Lee J, et al. Assessment of clinical, electrocardiographic, and physiological relevance of diagonal branch in left anterior descending coronary bifurcation lesions. J Am CollCardiolIntv 2012;5:1126:32.
- Davies J, Sen S, et al. Use of the instanteneous Wave-free ratio or fractional flow reserve in PCI: DEFINE-FLAIR trial. N Engl J Med 2017; 376:1824-34.
- Götberg M, Christiansen EH, et al. Instantaneous Wave-free ratio versus fractional flow reserve to guide PCI: iFR-SWEDEHEART trial. N Engl J Med 2017;376: 1813-23.
- Pijls NH, Fearon WF, Tonino PA, et al. Fractional flow reserve versus angiography for guiding percutaneous coronary intervention in patients with multivessel coronary artery disease: 2 –year follow-up of the FAME. J Am CollCardiol. 2010;56:177-84.
- De Bruyne B, Fearon WF, Pijls NH, et al. Fractional flow reserve-guided PCI for stable coronary artery disease: FAME-2 trial. N Eng J Med 2014:371:1208-17.
- Koo BK, Waseda K, Kang HJ, et al. Anatomic and functional evaluation of bifurcation lesions undergoing percutaneous coronay intervention. Circ CardiovascInterv 2010; 3:113-9.
- Stankovic G, Lefevre T, Chieffo A, et al. European bifurcation club. Consensus from the 7th European Bifurcation Club meeting. Eurointervention 2013;9:36-45.
- Yong AS, Daniels D, De Bruyne B, et al. Fractional flow reserve assessment of left main stenosis in the presence of downstream coronary stenoses. Circ CardiovascInterv 2013;6:161-5.
- Kumsars I, Narbute I, Thuesen L, et al. Nordic-Baltic PCI study group. Side branch fractional flow reserve measurements after main vessel stenting: a Nordic-Baltic Bifurcation Study III substudy. Euro Intervention 2012;7:1155-61.
- Legutko J, Yamawaki M, Costa R, et al. IVUS in bifurcation stenting: what have we learned?.Euro Intervention 2015;11:V55-V58.
- Chen SL, Ye F, Zhang JJ, et al. Intravascular ultrasound-guided systematic two-stent techniques for coronary bifurcation lesions and reduced late stent thrombosis. Catheter CardiovascInterv. 2013;81:456-63.
- De la Torre Hernandez JM, Baz JA, Gómez Hospital JA, et al. IVUS-Tronco-ICP Spanish study. Clinical impact of intravascular ultrasound guidance in drug-eluting stent implantation for unprotected left main coronary disease: patient level pooled analysis of 4 registries. J Am Coll Cardiol Intv. 2014;7:244-54.
- Ahn JM, Kang SJ, Yoon SH, et al. Meta-analysis of outcomes after intravascular ultrasound-guided versus angiography-guided drug-eluting stent implatation in 26,503 patients enrolled in three randomized trials and 14 observational studies. Am J Cardiol. 2014;113:1138-47.
- Ramsing N, Adriaenssens T, Motreff P, et al. OCT for bifurcation stenting: what have we learned. EuroIntervention 2015;11:V64-V70
- Kubo T, Akasaka T, Shite J, et al. OCT compared with IVUS in a coronary lesion assessment: the OPUS-CLASS study. JACC Cardiovas Imaging 2013;6:1095-104.
- Ali ZA, Maehara A, Généreux P, et al. Optical coherence tomography compared with intravascular ultrasound and with angiography to guide coronary stent implantation (ILUMIEN III: OPTIMIZE PCI): a randomised controlled trial. Lancet 2016;26:2618-28.
- Kang S, Ahn J, Song H, et al. Comprehensive Intravascular Ultrasound assessment of stent area and its impact on restenosis and adeverse cardiac in 403 patients with unprotected left main disease. Circ Cardiovasc Interv. 2011;4:562-569.




