O implante percutâneo da valva aórtica (TAVI) demonstrou ser uma excelente alternativa[1] no tratamento da estenose aórtica. Atualmente, em ao redor de 75 a 80% dos pacientes é realizado por via femoral (TF), o que o transforma no acesso de escolha. O acesso transapical (TA) é a alternativa mais comum quando a via TF não está disponível[2]. A maioria das publicações que o comparam com a via TF evidenciaram pior evolução pós-TAVI em relação a morte e eventos cardiovasculares[2, 3]. O acesso TA é especialmente desvantajoso em: portadores de patologia pulmonar severa ou pacientes extremamente frágeis que têm menor tolerância à realização de uma minitoracotomia. Adicionalmente, existe risco teórico de piorar o funcionamento dos ventrículos severamente deprimidos. Outras alternativas são os acessos subclávio (SC) ou transaórtico direto (TAo), utilizados em menor proporção. O acesso SC é desaconselhável em pacientes portadores de by-pass mamário pelo risco de lesionar sua origem, dado que a presença de tortuosidade subclávia dificulta o avanço da prótese. Um estudo observacional recentemente publicado compara os 4 acessos já mencionados e evidencia que, tanto os casos realizados por acessos TA quanto TAo tiveram um pior prognóstico em relação a morte e eventos cardiovasculares em curto e médio prazo[4]. Nenhum acesso alternativo mostrou ser uma alternativa ótima à via TF, motivando a avaliação do acesso transcarotídeo (TCa) como opção.
Os primeiros dois casos bem-sucedidos de tratamento percutâneo da EAo via TCa foram descritos em neonatos[5]. Evidentemente, existem significativas diferenças na patologia de adultos, sendo relevante a presença de ateromatose carotídea. A evidência mais próxima disponível em instrumentalização percutânea da carótida corresponde à angioplastia carotídea. Uma revisão sistemática que envolveu mais 1.500.000 casos de angioplastia ou endarterectomia carotídea revelou que a taxa de mortalidade ou acidente vascular cerebral (AVC) pós-angioplastia é em média de 3%[6]. O primeiro caso de TAVI via TCa foi relatado pelo grupo de Modini (Hospital de Lille, França). A Tortuosidade extrema da aorta abdominal e subclávia direita foram os motivos para escolher a via TCa[7]. O mesmo grupo relatou em 2012 uma série de 12 casos de EAo severa, portadores de doença vascular periférica severa. Realizou-se TAVI via TCa esquerda com 100% de sucesso, sendo que a taxa de refluxo aórtico grau III-IV pós-TAVR foi de zero[8]. O grupo de Azmoun relatou em 2013 a realização de TAVI via TCa em 19 pacientes, com sucesso em 18. Isso correspondeu a 10% de sua população submetida a TAVI. Dito grupo utilizou próteses Corevalve™ e Sapien XT™. Até o momento, a experiência mais importante na literatura corresponde ao Registro Francês de TAVI TCa realizado em 3 centros entre os anos 2009 e 2013. Efetuaram-se 96 casos, todos portadores de doença periférica severa. Conseguiu-se realização de TAVI bem-sucedido via TCa em 100%, tendo sido utilizado dispositivo Corevalve™ em 93% dos casos. A mortalidade associada ao procedimento foi de 3,1%, a incidência de eventos cerebrovasculares foi de 3,1%, sendo todos casos de ataque isquêmico transitório (AIT)[9].
A inserção do introdutor e material endovascular de grande calibre no nível da artéria carótida comum implica risco de isquemia cerebral. Em consequência, previamente à realização do procedimento deve-se verificar: um adequado calibre no nível da carótida comum para a inserção da prótese; a ausência de ateromatose severa; e presença de uma adequada compensação de fluxo cerebral. A ecografia Doppler carotídea permite avaliar o que se complementa com a tomografia axial computadorizada (TAC) efetuada habitualmente pré-TAVI. Esta última nos permite caracterizar o trajeto, a presença de placas de ateroma e o calibre carotídeo. Segundo o relatado na literatura, o calibre mínimo exigido para a carótida comum varia entre 6 e 7 mm de acordo com os diferentes grupos[9, 10]. Para verificar a presença de circulação colateral e perviedade do polígono de Willis, o registro francês TCa utilizou a ressonância magnética (RM) previamente à intervenção. No entanto, é um tema em discussão e outra opção é comprovar a circulação colateral por meio de métodos indiretos. Pode-se efetuar de modo prático durante a intervenção: ao expor a carótida comum, faz-se um “clampeamento”, verifica-se a pressão de perfusão distal 1 minuto pós-oclusão, a qual não deve cair a menos de 30 mmHg, e a saturometria cerebral em mais de 50%[11]. Caso o procedimento seja efetuado sob anestesia local, a resposta a avaliar é a consciência do paciente. A perda de consciência 3 minutos após o clampeamento é considerada circulação colateral insuficiente e requer o estabelecimento de um shunt transitório para realizar o TAVI [10]. Adicionalmente ao que foi dito anteriormente, realiza-se oximetria cerebral bilateral durante todo o procedimento, embora não haja consenso sobre cifras limite.
Teoricamente, instrumentalizar o território carotídeo poderia derivar em uma maior incidência de acidente vascular cerebral (AVC) ou ataque isquêmico transitório (AIT). O registro francês TCa relatou 3,1% de eventos neurológicos pós-procedimento e 6% em 30 dias, todos AIT. Os grupos de Azmoun e Thourani com 18 e 11 casos relatam 0% de AVC em 30 dias [4, 10]. Em nossa experiência local, de 16 casos realizados registrou-se 1 AVC. É possível que os bons resultados obtidos tenham relação com uma adequada seleção de pacientes e com a exclusão daqueles cuja anatomia ou carga de ateromatose carotídea é desfavorável. As cifras mencionadas se comparam favoravelmente com registros internacionais [12] e podemos obter conclusões quando tivermos mais registros via TCa. Em nenhum dos estudos mencionados houve complicações vasculares maiores relacionadas ao acesso carotídeo.
Para realizar TAVI via TCa não são requeridos materiais diferentes dos utilizados por via TF. A proximidade do acesso carotídeo em relação à raiz aórtica e ao alinhamento coaxial conseguido ao usar a via TCa esquerda proporcionam uma adequada liberdade de movimento, assim como favorecem o controle e correto posicionamento da prótese. A localização superficial da carótida comum permite à equipe cirúrgica alcançar facilmente o acesso e não é habitual que seja necessário estabelecer um shunt adicional para garantir a perfusão. Diferentemente dos acessos que requerem uma minitoracotomia, o acesso TCa permite oferecer a possibilidade de efetuar o procedimento sob anestesia local. Outro ponto importante, embora não esteja mencionado explicitamente dentre os resultados relevantes, é a excelente tolerância dos pacientes ao procedimento e ao pós-procedimento, o que permite uma rápida recuperação da deambulação.
Acesso carotídeo esquerdo vs. direito: no registro francês o acesso TCa esquerdo foi definido como o acesso de escolha, já que permite um alinhamento coaxial da prótese com a raiz aórtica. Ao contrário, uma apresentação oral recente feita por Cohen e cols. de 27 casos de TAVI via TCa, relatou que 20 foram realizados por via direita com sucesso[13]. O grupo de Azmoun realizou 44% de seus implantes por via direita[10].
No que se refere à anestesia, a experiência mais ampla publicada foi em relação a procedimentos realizados sob anestesia geral com alta taxa de sucesso e baixa taxa de complicações. Existem relatos de casos ou séries realizadas sob anestesia local com similares bons resultados[10, 14], o que pode proporcionar vantagens adicionais em pacientes portadores de doença pulmonar severa e favorecer a estabilidade hemodinâmica.
Baseando-se nas vantagens do acesso TCa, alguns grupos na França o propõem como primeira opção frente ao transapical, em pacientes com mal acesso femoral. Não existem estudos que comparem amplamente o acesso TA vs. TCa, a não ser uma série recentemente publicada por Thourani que compara diferentes acessos alternativos: 139 pacientes tratados por via TA e 11 por via TCa. Apesar do escore STS significativamente maior no grupo TCa, a incidência de eventos cardiovasculares e morte pós-TAVI foi similar para ambos os grupos[4].
Como conclusão podemos dizer que o acesso TCa é uma alternativa efetiva para realizar TAVI. Sua utilização requer um estudo prévio da anatomia e perviedade do eixo vascular carotídeo. A evidência publicada até o momento afiança sua segurança, o que o posiciona como um acesso a considerar em pacientes portadores de ateromatose ilíaco-femoral severa.
PASSO A PASSO
Passo 1: Verificar o cumprimento de critérios previamente estabelecidos para o uso do acesso[15]. É aconselhável planificar um acesso alternativo em caso de fracasso e ter a equipe cirúrgica preparada em caso de complicação maior.
Passo 2: Colocação de marca-passo transitório por via jugular e, caso se utilize ecocardiografia transesofágica, o mesmo é colocado posteriormente à intubação endotraqueal da anestesia geral.
Passo 3: Obtém-se um acesso arterial para inserir um cateter pigtail, sendo a via radial direita nossa primeira opção, considerando que este grupo de pacientes apresenta severa ateromatose do eixo ílio-femoral[16].
Passo 4: Incisão cervical (Figura 1): Habitualmente utilizamos a via TCa esquerda. No entanto, a via direita é igualmente factível[17]. A incisão se efetua ao longo da borda medial do músculo esternocleidomastóideo. Efetuam-se duas suturas hemostáticas[4].
Passo 5: Integridade funcional do polígono de Willis (Figura 2): Efetua-se um clampeamento da artéria carótida comum durante 1 minuto, verifica-se a pressão arterial imediatamente distal à zona de clampeamento e realiza-se a oximetria cerebral[18].
Passo 6: Punça-se a carótida comum entre as duas suturas hemostáticas e avança-se um guia 0,035” padrão – com extremidade curva – até a raiz aórtica. Insere-se um introdutor 7 French. Para o cruzamento da valva aórtica pode-se utilizar um cateter Judkins™ direito, Amplatz™ esquerdo ou Multipropósito. Guia reto 0,035” rumo ao ventrículo esquerdo ou guia hidrofílico.
Passo 7: Guia rígido 0,035” posicionando-o dentro do ventrículo e avança-se um introdutor correspondente à prótese a implantar (Figura 3).
Passo 8: Caso a equipe haja definido pré-dilatar antes do implante, avança-se um balão, efetua-se estimulação ventricular rápida e faz-se valvoplastia.
Passo 9: Por não haver curvaturas pronunciadas no trecho que vai da carótida à raiz aórtica, o avanço deveria ocorrer sem dificuldade (Figura 4). Na aortografia devem ser visualizados os 3 véus aórticos e o ângulo imaginário formado pelo eixo aórtico e a raiz aórtica deve estar próxima a 90º[19]. O anterior permite alinhar de modo simétrico a prótese valvar à raiz aórtica, independentemente do tipo de prótese a utilizar. Para verificar a adequada posição da prótese, pode-se efetuar uma ventriculografia previamente a seu deslocamento. Caso seja um dispositivo expansível com balão, é necessário realizar estimulação ventricular rápida. No deslocamento de uma prótese autoexpansível, não se requer estimulação ventricular a não ser que haja dificuldade em estabilizar o sistema.
Passo 10: Avalia-se por ecografia a presença de refluxo aórtico.
Passo 11: Retira-se completamente o introdutor a partir da carótida, evitando o sangramento mediante as suturas hemostáticas e o cirurgião repara o leito vascular carotídeo. Depois disso, verifica-se mediante sonografia o fluxo carotídeo proximal e distal à incisão efetuada.
Passo 12: Monitorização em sala de cuidados críticos.
Figuras
Figura 1: Incisão cervical
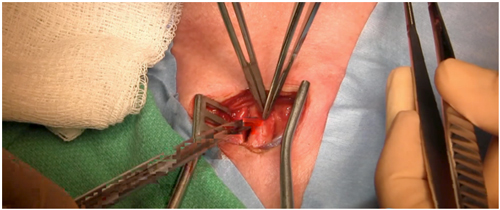
Figura 2: Verificação da integridade funcional da carótida
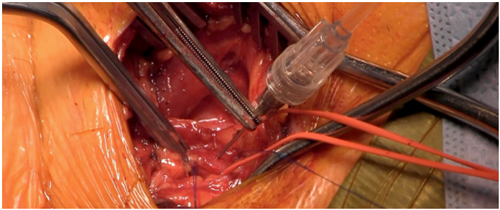
Figura 3: Introdutor da prótese
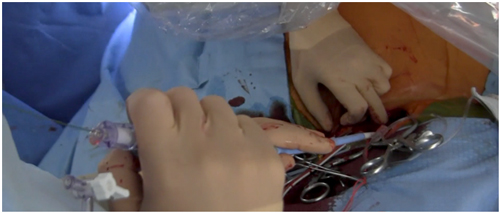
Figura 4: Posicionamento da prótese
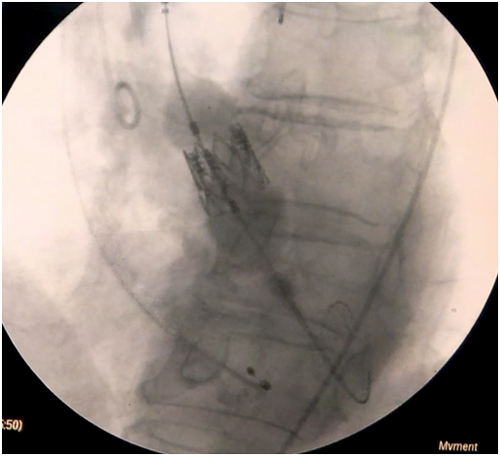
Bibliografia
- Smith, C.R., et al., Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med, 2011. 364(23): p. 2187-98.
- Frohlich, G.M., et al., Comparative survival after transapical, direct aortic, and subclavian transcatheter aortic valve implantation (data from the UK TAVI registry). Am J Cardiol, 2015. 116(10): p. 1555-9.
- Blackstone, E.H., et al., Propensity-matched comparisons of clinical outcomes after transapical or transfemoral transcatheter aortic valve replacement: a placement of aortic transcatheter valves (PARTNER)-I trial substudy. Circulation, 2015. 131(22): p. 1989-2000.
- Thourani, V.H., et al., High-risk patients with inoperative aortic stenosis: use of transapical, transaortic, and transcarotid techniques. Ann Thorac Surg, 2015. 99(3): p. 817-23; discussion 823-5.
- Weber, H.S., C.R. Mart, and J.L. Myers, Transcarotid balloon valvuloplasty for critical aortic valve stenosis at the bedside via continuous transesophageal echocardiographic guidance. Catheter Cardiovasc Interv, 2000. 50(3): p. 326-9.
- Paraskevas, K.I., E.L. Kalmykov, and A.R. Naylor, Stroke/Death Rates Following Carotid Artery Stenting and Carotid Endarterectomy in Contemporary Administrative Dataset Registries: A Systematic Review. Eur J Vasc Endovasc Surg, 2016. 51(1): p. 3-12.
- Modine, T., et al., Implantation of a Sapien XT aortic bioprosthesis through the left carotid artery. J Card Surg, 2014. 29(3): p. 337-9.
- Modine, T., et al., Transcutaneous aortic valve implantation using the left carotid access: feasibility and early clinical outcomes. Ann Thorac Surg, 2012. 93(5): p. 1489-94.
- Mylotte, D., et al., Transcarotid Transcatheter Aortic Valve Replacement: Feasibility and Safety. JACC Cardiovasc Interv, 2016. 9(5): p. 472-80.
- Azmoun, A., et al., Transcatheter aortic valve implantation through carotid artery access under local anaesthesia. Eur J Cardiothorac Surg, 2014. 46(4): p. 693-8; discussion 698.
- Campelo-Parada, F., et al., A Novel Transcarotid Approach for Implantation of Balloon-Expandable or Self-Expandable Transcatheter Aortic Valves. Can J Cardiol, 2016.
- Murashita, T., et al., Clinical Outcomes After Transapical and Transfemoral Transcatheter Aortic Valve Insertion: An Evolving Experience. Ann Thorac Surg, 2016. 102(1): p. 56-61.
- D, Cohen., Transcarotid TAVR: the forgotter alternative. Trascateter and Vascular Therapeutics 2016, personal comunication, 2015
- Rajagopal, R., R.S. More, and D.H. Roberts, Transcatheter aortic valve implantation through a transcarotid approach under local anesthesia. Catheter Cardiovasc Interv, 2014. 84(6): p. 903-7.
- Mylotte, D., et al., Transcarotid Transcatheter Aortic Valve Replacement: Feasibility and Safety. JACC Cardiovasc Interv, 2016. 9(5): p. 472-80.
- Fusini, L., et al., Incidence and severity of atherosclerotic cardiovascular artery disease in patients undergoing TAVI. Int J Cardiovasc Imaging, 2015. 31(5): p. 975-85.
- D, C., Transcarotid TAVR: the forgotter alternative. Trascateter and Vascular Therapeutics 2016, personal comunication, 2015.
- Campelo-Parada, F., et al., A Novel Transcarotid Approach for Implantation of Balloon-Expandable or Self-Expandable Transcatheter Aortic Valves. Can J Cardiol, 2016.
- Tops, L.F., et al., Noninvasive evaluation of the aortic root with multislice computed tomography implications for transcatheter aortic valve replacement. JACC Cardiovasc Imaging, 2008. 1(3): p. 321-30.
