El implante transcateter de válvula aórtica (TAVI) se ha establecido como la terapia de elección en pacientes con estenosis aórtica severa inoperables o de alto riesgo quirúrgico, y durante los últimos años en una alternativa a la cirugía en pacientes de riesgo intermedio.(1) A pesar de los grandes avances tecnológicos, el accidente cerebrovascular (ACV) sigue siendo una de las complicaciones más temidas, aumentando el riesgo de morbimortalidad a corto y largo plazo.(2) Los primeros estudios randomizados señalaban que la TAVI se asociaba con un mayor riesgo de ACV comparado a la terapia médica o el reemplazo valvular aórtico quirúrgico. Sin embargo, estudios más recientes no han confirmado esta asociación, mostrando tasas similares o incluso inferiores al tratamiento quirúrgico de la estenosis aórtica.(1,3,4) Si bien con los nuevos tipos de válvulas la incidencia de ACV clínico ha disminuido ligeramente, esta complicación sigue ocurriendo, con una variabilidad importante entre centros (de 1.5% a 5.5%) en función de la definición y la evaluación sistemática de test neurológicos por un especialista. Si se estudian las embolias subclínicas o silentes mediante estudios de difusión por resonancia magnética (RM), se ha demostrado que un 77,5% de los pacientes presentan nuevas lesiones cerebrales tras la TAVI.(5) La etiología es probablemente multifactorial y se han descritos que el 50% de los ACV ocurren en las primeras 24horas (agudos), mientras que la otra mitad son subagudos (1-30 días).(2) Los ACV agudos suelen estar relacionados con factores durante el procedimiento como podría ser el cruce de una válvula aórtica estenótica, calcificada y degenerada, manipulación de catéteres en el arco aórtico con severa aterosclerosis, valvuloplastia aórtica previo al implante, eventual mal posicionamiento, desprendimiento, embolización del dispositivo o necesidad de post dilatación en caso de leak paravalvular residual.(2,6,7) Los ACV subagudos (1-30 días), se han relacionado en varios estudios con la aparición de fibrilación auricular de reciente comienzo.(2,8) Mediante filtros en los troncos supraaórticos, se ha demostrado que durante el procedimiento se libera material embólico con cualquier tipo de válvula y la composición de este material embolico es heterogénea (trombo, tejido, material exógeno).(9-13) Por ello, parece que la TAVI libera inevitablemente material embólico por lo que la expansión de la técnica a pacientes de riesgo quirúrgico bajo justifican el desarrollo de medidas que busquen disminuir el riesgo neurológico.
Los sistemas de protección cerebral (SPC) nacen como una protección mecánica para impedir la embolización de partículas hacia el cerebro durante la intervención. Si se considera que la mayoría de los ACV en pacientes tratados con TAVI tienen un origen embólico, los SPC podrían reducir la cantidad de material embólico que se desplaza hacia el cerebro durante el procedimiento y minimizar el grado de lesión neurológica.
_
A la fecha se han estudiado 4 tipos de SPC (Tabla 1 y Figura 1) con diferencias principalmente en cuanto a diseño y rutas de acceso. Los deflectores, representados por los dispositivos Embrella (Edwards Lifesciences, Irvine, CA) y TriGuard (Keystone Heart Ltd, Caesarea, Israel) son liberados a lo largo de la curvatura externa del arco aórtico otorgando cobertura al troco braquicefálico, carótida común izquierda y en el caso del Triguard a la arteria subclavia izquierda rechazando el material embolizado hacia la aorta descendente. Por otra parte, existen los sistemas tipo filtros representados por Sentinel (Claret Medical Inc., Santa Rosa, CA) y Embol-X (Edwards Lifesciences, Irvine, CA). El primero contiene filtros que se liberan en el tronco braquiocefálico y la carótida común izquierda, y el segundo se posiciona en la aorta ascendente a través de esternotomía.
Tabla 1. Sistemas de protección cerebral disponibles en la actualidad.
|
Dispositivo |
Fabricante |
Diseño |
Acceso |
Diámetro |
Posicionamiento |
|
Embrella |
Edwards Lifesciences, Irvine, CA |
Deflector |
Radial/Braquial |
6F |
Arco aórtico |
|
TriGuard |
Keystone Heart Ltd, Caesarea, Israel |
Deflector |
Femoral |
9F |
Arco aórtico |
|
Sentinel |
Claret Medical Inc., Santa Rosa, CA |
Filtro |
Radial/Braquial |
6F |
1 filtro en tronco braquiocefálico y 1 filtro en arteria carótida común izquierda |
|
Embol-X |
Edwards Lifesciences, Irvine, CA |
Filtro |
Aórtico directo |
14F |
Aorta ascendente |
_
Figura 1: Sistemas de protección cerebral: (A) TriGuard (Keystone Heart Ltd, Caesarea, Israel); (B) Embrella (Edwards Lifesciences, Irvine, CA); (C) Embol-X (Edwards Lifesciences, Irvine, CA); (D) Sentinel (Claret Medical Inc., Santa Rosa, CA).
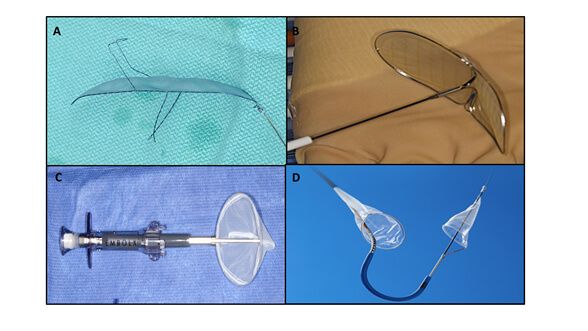
_
La evidencia disponible en relación a los SPC está constituida por una serie de estudios observacionales y 5 estudios randomizados(9-13), cuyas principales limitaciones han sido el número relativamente bajo de pacientes incluidos y utilizar como objetivo primario el volumen y número de nuevas lesiones cerebrales evaluadas por RM cerebral.
El ensayo multicéntrico randomizado DEFLECT III (n=85) evaluó el sistema de protección TriGuard. Se realizaron evaluaciones neurocognitivas basales, prealta y a los 30 días, junto con RM cerebral a los 4 ± 2 días y 30 días post procedimiento. El endpoint de seguridad (muerte, ACV, sangramiento mayor, daño renal agudo estadio 2 o 3, complicación vascular mayor) ocurrió en 21,7% del grupo intervenido y en un 30,8% del grupo control (p=0,34). En el grupo en quienes se obtuvo una cobertura completa de los 3 vasos cerebrales (88,9% del grupo intervenido), TriGuard se asoció con una mayor sobrevida libre de eventos (26,9% vs 11,5%) y menor déficit neurológico en escala NIHSS (3,1% vs 15,4%, p=0.16).(9)
Con el dispositivo EMBOL-X existe evidencia limitada en TAVI transaórtica con un único ensayo randomizado que incluyó 30 pacientes (14 pacientes con filtro), comparando las lesiones cerebrales por RM a los 7 días post procedimiento. En el grupo intervenido se demostró una disminución no significativa de nuevas lesiones cerebrales (57% vs 69%, p=0.70) y del volumen de las lesiones (88±60 vs 168±217 mm3, p=0.27).(10)
El ensayo multicéntrico randomizado MISTRAL-C (n=65) comparó el número de nuevas lesiones cerebrales evaluadas por RM y la función neurocognitiva pre y post TAVI (promedio 5 días) utilizando el dispositivo Claret Sentinel. El objetivo primario (porcentaje de pacientes con nuevas lesiones cerebrales) no se redujo en el grupo del dispositivo (73% vs 87%, p=0.31) con una tendencia a la reducción en el volumen de nuevas lesiones cerebrales (95mm3 vs 197mm3, p=0.171). Se observó una reducción significativa en el número de pacientes con lesiones cerebrales múltiples (20% vs 0%; p=0.03) y un menor deterioro cognitivo (4% vs 27%; p=0.017). Dentro de las limitaciones destaca que sólo se obtuvieron imágenes y test neurocognitivos post-TAVI en el 57% y 80% de los pacientes, respectivamente.(11)
El ensayo randomizado CLEAN-TAVI (n=100) con el dispositivo Claret Sentinel, demostró una reducción significativa en el número (8 vs 16, p<0.01) y volumen de nuevas lesiones cerebrales (466 mm3 vs 800 mm3, p=0.02) evaluado por resonancia a los 2 días post-intervención. Se registran 5 ACV menores en cada brazo de tratamiento.(12)
El estudio SENTINEL (n=363) es el estudio randomizado con mayor número de pacientes hasta la fecha con el dispositivo Claret Sentinel. El grupo intervenido requirió un mayor tiempo de fluoroscopía, con éxito en el implante del dispositivo en todos los pacientes y obteniendo en un 99% material embólico, en su mayoría de tipo no trombótico procedente de las paredes arteriales. El dispositivo no logró una disminución significativa en relación a volumen de nuevas lesiones cerebrales (178 mm3 vs 102.8 mm3, p=0.33) en RM cerebral entre los días 2 a 7 post TAVI y la función cognitiva fue similar tras evaluación a 30 y 90 días. Los eventos cardiovasculares combinados en el grupo intervenido con filtro fue de 7,3% vs un 9,9% en el grupo control (p=0.40). La tasa de stroke en el grupo intervenido no alcanzó una diferencia significativa (5,6% vs 9,1%; p=0.25).(13)
Posteriormente a los estudios randomizados se han publicado meta-análisis combinando los resultados, que concluyen que el número y el volumen de nuevas lesiones cerebrales se reduce a favor de los sistemas de protección cerebral, sin diferencias en cuanto a la tasa global de ACV o muerte de forma independiente (figura 2)(14). Sin embargo otro meta-análisis demostró una reducción del evento combinado muerte o ACV tras realizar un análisis por el método de efectos fijos.(15) Por último, un estudio reciente que incluyó 280 pacientes consecutivos tratados con el dispositivo Sentinel, detectó una reducción significativa de la tasa de ACV (1.4% vs 4.6%, p=0.03) y muerte o ACV (2.1% vs 6.8%, p=0.01) a 7 días tras compararlo mediante un análisis de propensión con una cohorte histórica.(16)
Figura 2: Análisis combinado de los ensayos clínicos con sistemas de protección cerebral en cuanto al número total de lesiones nuevas (A), volumen de las lesiones (B), ACV a 30 días (C) y muerte a 30 días (D). Reproducido con permiso de Bagur et al.(9)
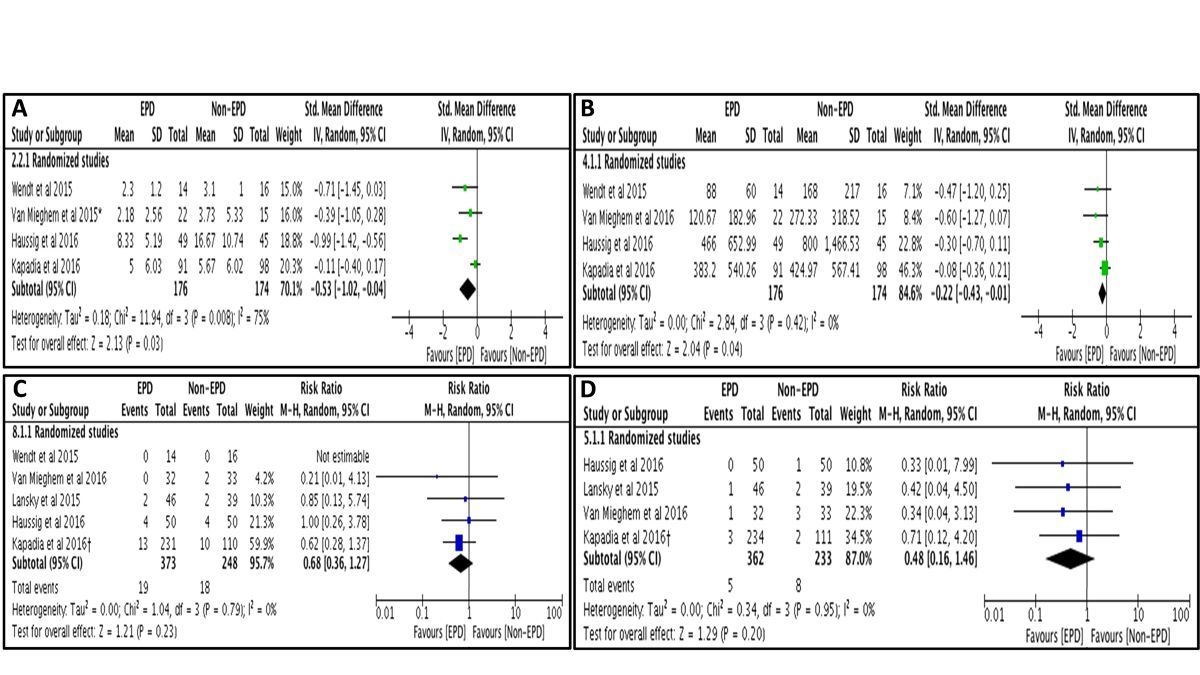
_
Los eventos clínicos neurológicos post-TAVI tienen una incidencia de un ~2-4%, con un impacto en la morbimortalidad. Los ensayos disponibles en la actualidad en su mayoría evalúan el daño neurológico en tres aspectos: clínico, subclínico y cognitivo, de los cuales el objetivo de eventos clínicos no se ha logrado disminuir de forma significativa con los SPC, y si mediante objetivos subrogados como la disminución del volumen y la tasa de nuevas lesiones cerebrales. Por ello, se necesitan estudios randomizados de mayor tamaño, que demuestren, no solo una reducción de lesiones cerebrales, sino un beneficio en la tasa de eventos clínicos y deterioro neurocognitivo, previo a una recomendación sistemática de SPC en todos los procedimientos de TAVI.