Sistemas de proteção cerebral em TAVI
Introdução
O implante percutâneo valvar aórtico (TAVI) se estabeleceu como a terapia de escolha em pacientes com estenose severa inoperáveis ou de alto risco cirúrgico, e durante os últimos anos tem se estabelecido como alternativa à cirurgia em pacientes de risco intermediário.(1) Apesar dos grandes avanços tecnológicos, o acidente vascular cerebral (AVC) continua sendo uma das complicações mais temidas, aumentando o risco de morbimortalidade a curto e longo prazo.(2) Os primeiros estudos randomizados assinalavam que o TAVI se associava a um maior risco de AVC comparado com a terapia médica e cirurgia de substituição da valva aórtica. No entanto, estudos mais recentes não confirmaram dita associação, mostrando taxas similares ou inclusive inferiores ao tratamento cirúrgico da estenose aórtica.(1,3,4) Embora a incidência de AVC clínico tenha diminuído com os novos tipos de válvulas, esta complicação continua ocorrendo, com uma significativa variabilidade entre centros (de 1,5% a 5,5%) em função da definição e da avaliação sistemática de testes neurológicos por um especialista. O estudo das embolias subclínicas ou silentes mediante estudos de difusão por ressonância magnética (RM) demonstrou que 77,5% dos pacientes apresentam novas lesões cerebrais após o TAVI.(5) A etiologia provavelmente seja multifatorial e já foi descrito que 50% dos AVC ocorrem nas primeiras 24 horas (agudos), ao passo que a outra metade são subagudos (1-30 dias).(2) Os AVC agudos costumam estar relacionados com fatores durante o procedimento, como poderia ser o cruzamento de uma valva aórtica estenótica, calcificada e degenerada, manipulação de cateteres no arco aórtico com severa aterosclerose, valvoplastia aórtica prévia ao implante, eventual mal posicionamento, desprendimento, embolização do dispositivo ou necessidade de pós-dilatação em caso de regurgitação paravalvar residual. (2,6,7) Os AVC subagudos (1-30 dias) se relacionaram em vários estudos com o aparecimento de fibrilação atrial de recente começo.(2,8) Mediante filtros nos troncos supra-aórticos, demonstrou-se que durante o procedimento se libera material embólico com qualquer tipo de válvula e a composição deste material embólico é heterogênea (trombo, tecido, material exógeno).(9-13) Por isso, tudo indica que o TAVI libera inevitavelmente material embólico, motivo pelo qual a expansão da técnica a pacientes de risco cirúrgico baixo justifica o desenvolvimento de medidas que busquem diminuir o risco neurológico.
Os sistemas de proteção cerebral (SPC) nascem como uma proteção mecânica para impedir a embolização de partículas rumo ao cérebro durante a intervenção. Se considerarmos que a maioria dos AVC em pacientes tratados com TAVI tem uma origem embólica, os SPC poderiam reduzir a quantidade de material embólico que se desloca para o cérebro durante o procedimento, minimizando assim o grau de lesão neurológica.
_
Dispositivos de proteção cerebral
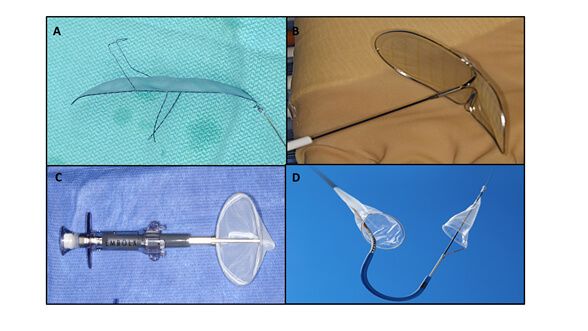
Até o momento foram estudados 4 tipos de SPC (Tabela 1 e Figura 1), com diferenças principalmente no que se refere a desenho e vias de acesso. Os deflectores, representados pelos dispositivos Embrella (Edwards Lifesciences, Irvine, CA) e TriGuard (Keystone Heart Ltd, Caesarea, Israel) são liberados ao longo da curvatura externa do arco aórtico e proporcionam cobertura ao tronco braquiocefálico, à carótida comum esquerda e, no caso do Triguard, à artéria subclávia esquerda, rechaçando o material embolizado rumo à aorta descendente. Por outro lado, existem os sistemas tipo filtros representados pelo Sentinel (Claret Medical Inc., Santa Rosa, CA) e Embol-X (Edwards Lifesciences, Irvine, CA). O primeiro contém filtros que se liberam no tronco braquiocefálico e na carótida comum esquerda, e o segundo se posiciona na aorta ascendente através de esternotomia.
Tabela 1. Sistemas de proteção cerebral disponíveis na atualidade.
|
Dispositivo |
Fabricante |
Desenho |
Acesso |
Diâmetro |
Posicionamento |
|
Embrella |
Edwards Lifesciences, Irvine, CA |
Deflector |
Radial/Braquial |
6F |
Arco aórtico |
|
TriGuard |
Keystone Heart Ltd, Caesarea, Israel |
Deflector |
Femoral |
9F |
Arco aórtico |
|
Sentinel |
Claret Medical Inc., Santa Rosa, CA |
Filtro |
Radial/Braquial |
6F |
1 filtro em tronco braquiocefálico e 1 filtro em artéria carótida comum esquerda |
|
Embol-X |
Edwards Lifesciences, Irvine, CA |
Filtro |
Aórtico direto |
14F |
Aorta ascendente |
_
Figura 1: Sistemas de proteção cerebral: (A) TriGuard (Keystone Heart Ltd, Caesarea, Israel); (B) Embrella (Edwards Lifesciences, Irvine, CA); (C) Embol-X (Edwards Lifesciences, Irvine, CA); (D) Sentinel (Claret Medical Inc., Santa Rosa, CA).
Ensaios clínicos randomizados
A evidência disponível em relação aos SPC está constituída por uma série de estudos observacionais e estudos randomizados (9-13), cujas principais limitações foram o número relativamente baixo de pacientes incluídos e o fato de utilizar como objetivo primário o volume e o número de novas lesões cerebrais avaliadas por RM cerebral.
O ensaio multicêntrico randomizado DEFLECT III (n = 85) avaliou o sistema de proteção TriGuard. Foram feitas avaliações neurocognitivas basais antes da alta e em 30 dias, assim como RM cerebral em 4 ± 2 dias e 30 dias pós-procedimento. O desfecho de segurança (morte, AVC sangramento maior, dano renal agudo estágio 2 ou 3, complicação vascular maior) ocorreu em 21,7% do grupo que recebeu proteção e em 30,8% do grupo controle (p = 0,34%). No grupo no qual se obteve uma cobertura completa dos 3 vasos cerebrais (88,9% do grupo que recebeu intervenção), o TriGuard se associou com uma maior sobrevida livre de eventos (26,9% vs. 11,5%) e um menor déficit neurológico em escala NIHSS (3,1% VS. 15,4%; P = 0,16).(9)
Com o dispositivo EMBOL-X existe evidencia limitada em TAVI transaórtico com um único ensaio randomizado que incluiu 30 pacientes (14 pacientes com filtro), comparando as lesões cerebrais por RM 7 dias após o procedimento. No grupo que recebeu proteção se demonstrou uma diminuição não significativa de novas lesões cerebrais (57% vs. 69%, p = 0,70) e do volume das lesões (88 ± 60 vs. 168 ± 217 mm3; p = 0,27).(10)
O ensaio multicêntrico randomizado MISTRAL-C (n = 65) comparou o número de novas lesões cerebrais avaliadas por RM e a função neurocognitiva pré e pós-TAVI (média 5 dias) utilizando o dispositivo Claret Sentinel. O objetivo primário (porcentagem de pacientes com novas lesões cerebrais) não se reduziu no grupo do dispositivo (73% vs. 87%; p = 0,31) com uma tendência à redução no volume de novas lesões cerebrais (95 mm3 vs. 197mm3; p = 0,171). Observou-se uma redução significativa no número de pacientes com lesões cerebrais múltiplas (20% vs. 0%; p = 0,03) e um menor deterioro cognitivo (4% vs. 27%; p = 0,017). Dentro das limitações destaca-se o fato de só terem sido obtidas imagens e testes neurocognitivos pós-TAVI em 57% e 80% dos pacientes, respectivamente.(11)
O ensaio randomizado CLEAN-TAVI (n = 100) com o dispositivo Claret Sentinel, demostrou uma redução significativa no número (8 vs. 16; p < 0,01) e volume de novas lesões cerebrais (466 mm3 vs. 800 mm3, p = 0,02) avaliado por ressonância 2 dias após a intervenção. Foram registrados 5 AVC menores em cada braço de tratamento. (12)
O estudo SENTINEL (n = 363) é o estudo randomizado com maior número de pacientes até o momento com o dispositivo Claret Sentinel. O grupo que recebeu proteção requereu um maior tempo de fluoroscopia, com sucesso no implante do dispositivo em todos os pacientes e obtenção de material embólico em 99% dos casos, em sua maioria de tipo não trombótico procedente das paredes arteriais. O dispositivo não conseguiu uma diminuição significativa do volume de novas lesões cerebrais (178 mm3 vs. 102,8 mm3; p = 0,33) em RM cerebral entre os dias 2 a 7 pós-TAVI e a função cognitiva foi similar após a avaliação em 30 e 90 dias. Os eventos cardiovasculares combinados no grupo que recebeu proteção com filtro foram de 7,3% vs. 9,9% no grupo controle (p = 0,40). A taxa de AVC no grupo que recebeu proteção não alcançou uma diferença significativa (5,6% vs. 9,1%; p = 0,25).(13)
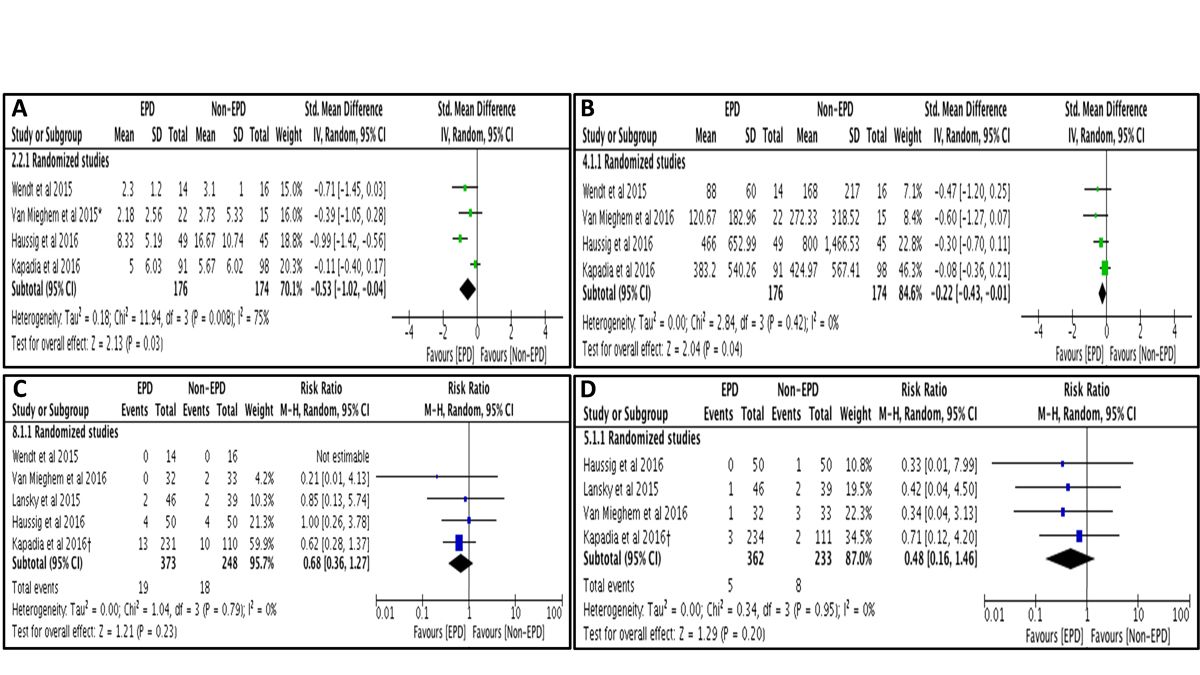
Posteriormente aos estudos randomizados foram publicadas metanálises combinando os resultados, que concluem que o número e o volume de novas lesões cerebrais se reduz a favor dos sistemas de proteção cerebral, sem diferenças no que se refere à taxa global de AVC ou morte de forma independente (figura 2)(14). Entretanto, outra metanálise demonstrou uma redução do evento combinado morte ou AVC após a realização de uma análise pelo método de efeitos fixos.(15) Por último, um estudo recente que incluiu 280 pacientes consecutivos tratados com o dispositivo Sentinel, detectou uma redução significativa da taxa de AVC (1,4% vs. 4,6%; p = 0,03) e morte ou AVC (2,1% vs. 6,8%; p = 0,01) em 7 dias depois de compará-lo mediante uma análise de propensão com uma coorte histórica. (16)
Figura 2: Análise combinada dos ensaios clínicos com sistemas de proteção cerebral quanto ao número total de novas lesões (A), volume das lesões (B), AVC em 30 dias (C) e morte em 30 dias (D). Reproduzido com autorização de Bagur et al. (9)
_
Conclusões
Os eventos clínicos neurológicos pós-TAVI têm uma incidência de aproximadamente 2-4%, com um impacto na mortalidade. Os ensaios disponíveis na atualidade em sua maioria avaliam o dano neurológico em três aspectos: clínico, subclínico e cognitivo, dentre os quais não se conseguiu reduzir significativamente o objetivo de eventos clínicos com os SPC, e sim mediante objetivos secundários como a diminuição do volume e da taxa de novas lesões cerebrais. Por isso são necessários estudos randomizados de maior magnitude que demonstrem não só uma redução de lesões cerebrais, mas também um benefício na taxa de eventos clínicos e deterioro neurocognitivo, previamente a uma recomendação sistemática de SPC em todos os procedimentos de TAVI.
Referências:
- Leon M.B., et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med 2016;374:1609-1620.
- Nombela-Franco L, et al. Timing, predictive factors, and prognostic value of cerebrovascular events in a large cohort of patients undergoing transcatheter aortic valve implantation. Circulation 2012;126:3041–53.
- Reardon MJ, et al. Surgical or Transcatheter Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2017;376:1321-1331.
- Thourani VH, et al. Transcatheter aortic valve replacement versus surgical valve replacement in intermediate-risk patients: a propensity score analysis. Lancet. 2016;387:2218-25.
- Latib A., et al. Cerebral Embolic Protection During Transcatheter Aortic Valve Replacement: A Disconnect Between Logic and Data?. J Am Coll Cardiol. 2017;69:378-380.
- Jochheim D, et al. Predictors of cerebrovascular events at mid-term after transcatheter aortic valve implantation - Results from EVERY-TAVI registry. Int J Cardiol. 2017;244:106-111.
- Kahlert P., et al. Cerebral embolization during transcatheter aortic valve implantation: a transcranial Doppler study. Circulation. 2012;126:1245-55.
- Auffret V, et al. Predictors of Early Cerebrovascular Events in Patients With Aortic Stenosis Undergoing Transcatheter Aortic Valve Replacement. J Am Coll Cardiol. 2016;68:673-84
- Lansky A.J., et al. A prospective randomized evaluation of the TriGuard™ HDH embolic DEFLECTion device during transcatheter aortic valve implantation: results from the DEFLECT III trial. Eur Heart J. 2015;36:2070-2078.
- Wendt D., et al. Intraaortic Protection From Embolization in Patients Undergoing Transaortic Transcatheter Aortic Valve Implantation. Ann Thorac Surg. 2015;100:686-91.
- Van Mieghem NM, et al. Filter-based cerebral embolic protection with transcatheter aortic valve implantation: the randomised MISTRAL-C trial. 2016;12:499-507.
- Haussig S., et al. Effect of a Cerebral Protection Device on Brain Lesions Following Transcatheter Aortic Valve Implantation in Patients With Severe Aortic Stenosis: The CLEAN-TAVI Randomized Clinical Trial. JAMA. 2016 Aug 9;316(6):592-601.
- Kapadia SR, et al. Protection Against Cerebral Embolism During Transcatheter Aortic Valve Replacement. J Am Coll Cardiol. 2017;69:367-377.
- Bagur R., et al. Cerebral Embolic Protection Devices During Transcatheter Aortic Valve Implantation: Systematic Review and Meta-Analysis. Stroke. 2017;48:1306-1315.
- Giustino G., et al. Cerebral embolic protection during TAVR: A clinical event meta-analysis. J Am Coll Cardiol 2017;69:465-466.
- Seeger J., et al. Cerebral Embolic Protection During Transfemoral Aortic Valve Replacement Significantly Reduces Death and Stroke Compared With Unprotected Procedures. J Am Coll Cardiol Intv, 2017;10:2297-2303.




