Implante de stent ductal en cardiopatías con circulación pulmonar conducto-dependiente
Introducción
En ausencia de tratamiento, las cardiopatías congénitas con flujo pulmonar dependiente del conducto arterioso provocan un deterioro clínico potencialmente letal. Por mencionar algunas, estas lesiones incluyen la estenosis pulmonar crítica, la atresia pulmonar con septum interventricular intacto, la atresía tricuspídea y la tetralogía de Fallot y/o sus variantes (p.ej. con atresia pulmonar; tipo doble salida de ventrículo derecho). Mantener el flujo pulmonar a partir de la circulación sistémica resulta primordial en las primeras horas o días de establecido el diagnóstico. El manejo inicial, prácticamente universal en la actualidad, consiste en la utilización de prostaglandina E1 (PGE1) intravenosa para evitar la tendencia natural de cierre espontáneo del conducto en lo que logra definirse una estrategia quirúrgica definitiva (reparación total vs. estrategia paliativa).
Tradicionalmente, el abordaje quirúrgico paliativo consiste en la realización de una fístula sistémico-pulmonar (FSP) siendo la más comúnmente utilizada la conexión entre la arteria subclavia y la arteria pulmonar mediante la colocación de un injerto protésico (tipo Blalock-Taussig modificada). El objetivo es simple: asegurar el flujo pulmonar y promover el crecimiento de las ramas pulmonares, habitualmente hipoplásicas en este tipo de pacientes. Cabe señalar que pese a ser un procedimiento practicado desde hace ya más de siete décadas, la realización de una FSP se ve limitada por distintos factores, entre ellos, la experiencia institucional y aquellos inherentes al paciente como la prematurez o el bajo peso. La mortalidad del procedimiento es considerable (alrededor de 7%) lo mismo que una morbilidad importante cercana al 14%.1 Entre otras, las complicaciones de una FSP incluyen trombosis aguda, parálisis del nervio vago o laríngeo recurrente y quilotórax; además, puede causar distorsión y crecimiento desigual de las arterias pulmonares aunado a la presencia de adhesiones dificultando procedimientos quirúrgicos subsecuentes.2,3
El implante de un stent ductal ofrece una alternativa menos invasiva al procedimiento quirúrgico paliativo convencional. La primera descripción del procedimiento fue publicado por Gibbs en 1991 como un método no quirúrgico para asegurar el flujo pulmonar en recién nacidos y lactantes con circulación dependiente del conducto (Gibbs).4 En la actualidad, el implante del stent ductal se ha convertido en una opción real de tratamiento paliativo en un buen número de centros cardiológicos alrededor del mundo. El objetivo de esta revisión pretende detallar aspectos relevantes del procedimiento con particular énfasis en la efectividad y la seguridad del tratamiento.
Anatomía del conducto arterioso
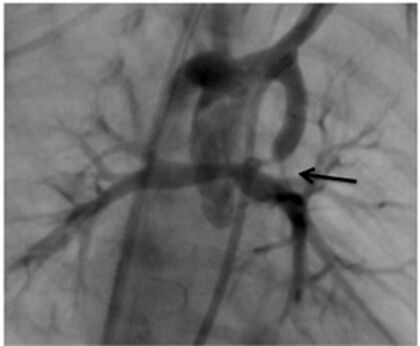
Las variantes morfológicas del conducto arterioso en el recién nacido con circulación pulmonar conducto-dependiente requieren atención especial cuando se intenta colocar un stent, principalmente en aquellos pacientes que no tienen una fuente adicional de flujo pulmonar. Es importante determinar su forma, tamaño y longitud lo que definirá su trayecto (p.ej. vertical o tortuoso) hasta desembocar en la confluencia de las ramas pulmonares o selectivamente en el origen de alguna de éstas, habitualmente la izquierda. En pacientes con atresia pulmonar, el origen del conducto puede tener un origen más proximal y desde la superficie inferior del arco aórtico. En algunos casos, el conducto puede originarse de la arteria subclavia o tronco braquiocefálico contralateral y en raras ocasiones puede existir un doble conducto (bilateral) conectando a ramas pulmonares no confluentes. Por último, no es infrecuente identificar estenosis ductal justo antes del sitio de su inserción con la rama pulmonar (Figura 1), situación que deberá ser tomada en cuenta al momento de la intervención.
Aspectos Técnicos
No existe un acuerdo generalizado en relación a la suspensión de la infusión con PGE1 previo a la colocación del stent ductal. Algunos autores se inclinan por suspender la infusión una noche previa al procedimiento,5 mientras otros deciden hacerlo minutos antes de iniciar el caso.6 En ambos escenarios, el objetivo persigue disminuir el diámetro del conducto para facilitar un mejor adosamiento del stent a la pared ductal. Nuestra conducta es variable, aunque más consistente con suspender la infusión de PGE1 por lo menos unas 12 horas antes del procedimiento. Sin embargo, en casos de pacientes con cianosis acentuada (SaO2 < 75% por oximetría de pulso) nuestra preferencia es mantenerlos bajo la infusión continua de PGE1 durante el procedimiento y suspenderla una vez colocado el stent y aliviada la cianosis.
El procedimiento se lleva a cabo bajo anestesia general. Es recomendable tener una monitorización hemodinámica completa que incluya idealmente una línea arterial (presión invasiva) y un catéter venoso central, útil en caso de necesitar fármacos, inotrópicos o hemoderivados.
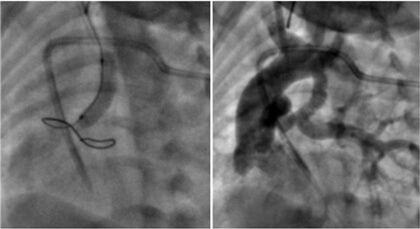
Los métodos de imagen no invasiva realizados previo al procedimiento (p.ej. ecocardiograma o tomografía computada) orientan en la mayoría de los casos nuestra elección para definir el sitio de acceso vascular. Cuando el conducto nace de la aorta descendente y sigue un trayecto recto (horizontal), el acceso a través de la arteria femoral con un introductor 4 ó 5Fr suele ser suficiente. En casos donde el nacimiento del conducto se origina en un punto proximal del arco aórtico y sigue un trayecto tortuoso el acceso axilar o carotídeo provee una ruta directa que simplifica la intervención (Figura 2).7 Nuestra conducta involucra el apoyo del servicio de cirugía cardiovascular para realizar la disección de la arteria carótida y efectuar la punción del vaso bajo visión directa. Una vez establecido el acceso vascular, administramos heparina a razón de 50-100UI/kg de peso.
Las proyecciones angiográficas comúnmente empleadas para visualizar el origen y trayecto del conducto incluyen una vista frontal, lateral izquierda (Figura 3A) y proyecciones oblicuas ya sea izquierda o derecha con ligero grado de angulación craneal. Utilizamos una guía de angioplastia coronaria 0.014” hidrofílica con extra-soporte para cruzar el conducto y alojarla idealmente en un ramo lobar distal de la rama pulmonar (Figura 3B). La colocación del stent puede llevarse a cabo en la mayoría de las ocasiones a través de un introductor 4Fr o en ocasiones a través de un catéter JR 5Fr guía. Habitualmente se utilizan stents coronarios premontados no liberadores de fármaco, aunque también se ha reportado recientemente la utilización de estos últimos con resultados interesantes.8 La longitud del stent debe cubrir la totalidad del conducto y debe anticiparse un acortamiento del 15-20% al momento de llevar a su expansión total. Es recomendable que la longitud del stent sea escasos milímetros mayor que la longitud total del conducto y abarque estrictamente tanto el cabo pulmonar como el aórtico ya que segmentos descubiertos son propensos a la formación de estenosis.9 En pacientes con un peso menor de 3kg generalmente se utilizan stents de 3.5mm de diámetro mientras que en mayores de 3kg, se favorece utilizar stents de 4mm.5,10,11 Se utiliza un insuflador para permitir una dilatación progresiva, secuencial y controlada del balón vigilando las atmósferas señaladas por el insuflador, cuidando no exceder el punto máximo de ruptura del balón (Figura 3C). Una vez alcanzada la expansión deseada del stent se desinfla el balón y se retira con precaución para evitar atrapamiento y/o ruptura. Se realizan angiografías de control para verificar la posición del stent dentro del conducto y en relación a la aorta y las ramas pulmonares (Figura 3D). En casos donde se identifiquen porciones descubiertas del conducto, se puede colocar un segundo stent para cubrir la longitud completa del vaso.
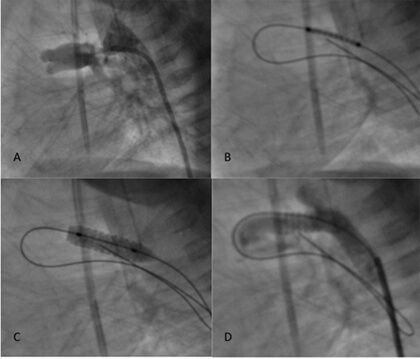
Figura 3.
Técnica de implantación de stent ductal
- Aortografia en proyección lateral mostrando un conducto arterioso con trayecto horizontal en su unión al tronco de la arteria pulmonar.
- Stent coronario premontado ubicado dentro del conducto avanzando sobre guía de angioplastia 0.014”.
- Dilatación del catetér-balón entregando stent con buen adosamiento a la pared ductal.
- Angiografía de control mostrando adecuado paso de medio de contraste de aorta hacia arteria pulmonar a través del stent.
_
Los cuidados post-cateterismo deben llevarse a cabo en una unidad de cuidado intensivo por lo menos durante las primeras 48 horas. Una vez lograda la hemostasia en el sitio de acceso vascular iniciamos una infusión de heparina a dosis de 10 a 15 UI/kg/hora por las siguientes 24 horas. Una vez que se ha reestablecido la alimentación enteral iniciamos anti agregación plaquetaria con ácido acetil salicílico (3-5mg/kg/día) una vez al día y de forma indefinida hasta la reparación quirúrgica en una etapa subsecuente.
Resultados inmediatos y a mediano plazo
La tabla muestra los resultados inmediatos después de la colocación de un stent ductal de acuerdo a lo publicado en algunas de las series disponibles más relevantes (incluida nuestra experiencia aún sin publicar). En términos generales, el resultado inmediato es exitoso entre un 80 y 100% de los casos tomando como criterio el incremento notable en la saturación arterial una vez colocado el stent. En casos que ameritan reintervención temprana, la razón principal obedece a la necesidad de colocar stents adicionales, ya que como se mencionó anteriormente, segmentos ductales descubiertos del stent original tienden a constreñirse provocando cianosis recurrente. La mortalidad temprana (previo al egreso del paciente) está reportada entre un 0 y 10%, con la mayoría de las series concluyendo que está relacionada a complicaciones respiratorias o infecciosas subyacentes y no atribuibles directamente al implante del stent. Nuestra mortalidad a menos de 30 días fue del 28%. Relacionadas directamente al procedimiento sucedieron en 4 pacientes (de los cuales 3 ocurrieron desde que adoptamos esta estrategia de intervención en el año 2005 y sea reflejo de nuestra curva de aprendizaje en el proceso).
Varios estudios señalan la efectividad que tiene el stent ductal para promover el crecimiento del árbol vascular pulmonar.16-18 Santoro y cols. demostraron que el flujo pulmonar logra distribuirse de una forma uniforme permitiendo un desarrollo adecuado y equilibrado de las ramas pulmonares.16 Esta situación se extiende a pacientes con fisiología univentricular que alcanzan un tamaño de ramas pulmonares apropiado al momento de una derivación cavopulmonar bidireccional.18
A mediano y largo plazo, la permeabilidad del stent ductal es menor cuando se compara con una FSP. Estudios histológicos experimentales en un inicio demostrarón que la estenosis intrastent es producto de la proliferación neointimal tanto en el centro del dispositivo como en los bordes aórtico y pulmonar.19 Behnke y cols. reportaron una tasa de reestenosis del 43% durante el seguimiento.11 Otros han señalado que puede existir obstrucción de la luz del conducto hasta en un 75% después de los seis meses de la intervención.12 En términos generales, los stents ductales han mostrado mantener su permeabilidad más allá de 6 meses (algunos reportes hasta 36 meses), tiempo razonablemente suficiente para definir en la mayoría de los casos el proyecto quirúrgico individual que cada paciente amerite.
_
Tabla. Resultados de implante de stent ductal en cardiopatías congénitas con flujo pulmonar dependiente de conducto arterioso
|
Referencia |
n |
Edad (mediana) |
Peso (kg) |
Efectividad (%) |
Complicaciones (n) |
Reintervención |
Mortalidad (%)(< 30 días o previo a egreso) |
|
Schneider 1998 (12) |
21 |
13 días |
3.1 |
100 |
Lesión vascular (2) |
Stent adicional (2) |
10 |
|
Gwellig 2004 (9) |
10 |
6 días |
3.3 |
100 |
|
Stent adicional (1) |
10 |
|
Michel-Benke 2004 (11) |
21 |
10 días |
3.3 |
95 |
Migración del stent (3) Trombosis aguda (2) |
Stent adicional (3) |
10 |
|
Alwi 2004 (10) |
56 |
2.3 meses |
3.9 |
91 |
Migración del stent (1) |
|
3 |
|
Celebi 2007 (13) |
10 |
3.5 meses |
5.4 |
80 |
|
|
0 |
|
Santoro 2008 (14) |
26 |
15 días (media) |
3.3 (media) |
92 |
Migración del stent (2) |
|
0 |
|
Schranz 2010 (6) |
27 |
6 días |
3.2 |
100 |
Migración del stent (1) |
Redilatación (2) Stent adicional (1) |
0 |
|
Erdem 2011(15) |
45 |
66 días (media) |
4.4 (media) |
93 |
|
|
0 |
|
Sivakumar 2012 (17) |
22 |
13 días |
|
100 |
|
|
0 |
|
Celebi 2017 (18) |
68 |
26 días |
3.6 |
95 |
Migración del stent (1) Espasmo ductal (2) |
Stent adicional (2) |
7 |
|
Sandoval 2017 * |
49 |
12 días |
2.9 |
92 |
Lesión vascular (1) Trombosis aguda (2) |
|
28 |
*Serie aún sin publicar.
_
Limitantes y Complicaciones
En nuestro centro cardiovascular, hemos optado por el stent ductal como primera línea de enfrentamiento en recién nacidos con cardiopatías congénitas con flujo pulmonar dependiente de conducto arterioso, susceptibles de estrategia paliativa. Existen, sin embargo, algunas condiciones anatómicas intrínsecas del conducto arterioso como la tortuosidad excesiva o el tamaño (amplios) que inclinan nuestra decisión por una FSP tradicional. Por otro lado, la presencia de estenosis selectiva de una rama de la arteria pulmonar genera un desafío para la implantación de un stent en el conducto arterioso. En este contexto, un stent ductal puede exacerbar la estenosis preexistente y generar distorsión de la rama de la arteria pulmonar. Al respecto, compartimos lo señalado por Alwi y colaboradores en cuanto a la presencia de estenosis de alguna rama de la arteria pulmonar (incluyendo estenosis ligeras) como una contraindicación absoluta en pacientes con un corazón univentricular.10
La seguridad del procedimiento se ha demostrado ampliamente y en la actualidad la incidencia de complicaciones es baja. Se han reportado complicaciones incluyendo lesión vascular en el sitio de acceso o la migración o desplazamiento del stent hacia la aorta o arteria pulmonar. El espasmo del conducto arterioso ocurre en menos del 1% de los casos y se presenta por lo general como consecuencia de sobre manipulación con la guía para canular y asegurar la posición dentro del conducto. Clínicamente se manifiesta por desaturación progresiva y de tener la guía en posición requiere de una expedita intervención para colocar stent. De lo contrario, se debe reiniciar la infusión de PGE1 y trasladar al paciente a sala de operaciones para realizar una FSP en calidad de urgencia.5
La trombosis aguda del stent es una complicación poco frecuente ocurriendo en el 1% de nuestra experiencia de stent ductal en el recién nacido. Es una situación grave que amenaza la vida del paciente y por tanto requiere de intervención inmediata. Generalmente puede sospecharse cuando después de haber logrado un incremento en la saturación arterial después de colocado el stent, existe desaturación de manera súbita y progresiva. Una angiografía revela la presencia de un trombo parcial o totalmente oclusivo dentro del stent (Figura 4). Es urgente tratar de recanalizar el trombo con la guía de angioplastia coronaria 0.014” y avanzar un balón coronario para realizar dilataciones repetidas con la finalidad de romper mecánicamente el trombo. La terapia trombolítica puede complementar el manejo en estos casos, a menos de que se considere necesario la realización de una FSP.
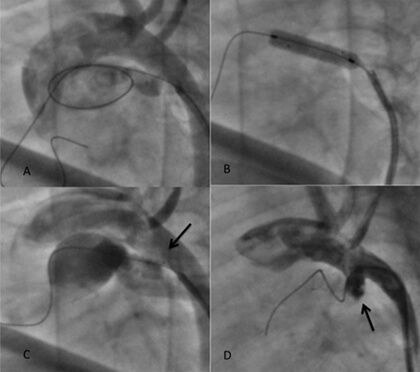
Figura 4.
Trombosis aguda de stent
- Aortografia mostrando un conducto arterioso con un trayecto tortuoso.
- Implante del stent dentro del conducto arterioso.
- Angiografía de control que muestra cobertura incompleta del stent en el segmento aórtico del conducto (flecha)
- Trombosis completa del stent pocos minutos después de su colocación.
_
Conclusión
La colocación de un stent ductal es un procedimiento seguro y efectivo para mantener el flujo pulmonar en pacientes cardiópatas con flujo pulmonar dependiente del conducto arterioso. La decisión de realizar la intervención como alternativa a la FSP dependerá de la preferencia y experiencia de cada centro cardiovascular en particular.
Referencias
- Petrucci, S. O’Brien, L. Marshall, J. Jacobs, P. Manning, et al. Risk factors for mortality and morbidity after the neonatal Blalock-Taussig shunt procedure. Ann Thorac Surg 2011;92(2):642-652
- Fenton KN, Siewers RD, Rebovich B, Pigula FA. Interim mortality in infants with systemic to pulmonary artery shunts. Ann Thorac Surg 2003;76:152-157
- Fermanis GG, Ekangaki AK, Salmon AP, Keeton BR, Shore DF, et al: Twelve year experience with the modified Blalock-Taussig shunt in neonates. Eur J Cardiothorac Surg 1992;6:586-9
- Gibbs J, Rothman M, Rees M, Parsons J, Blackburn M, et al. Stenting of the arterial duct: a new approach to palliation of pulmonary atresia. Br Heart J 1992;67:240-5
- Alwi M. Stenting the ductus arteriosus: Case selection, technique and possible complications. Ann Pediatr Card 2008;1:38-45
- Schranz D, Michel-Behnke I, Heyer R, Vogel M, Bauer J, et al. Stent implantation of the Arterial Duct in Newborns with a Truly Duct-Dependent Pulmonary Circulation: A Single-Center experience with Emphasis on Aspects of the Interventional Technique. J Interven Cardiol 2010;23:581-588
- Kenny D, Berman D, Zahn E, Amin Z. Variable approaches to arterial duct stenting in infants with complex congenital heart disease. Catheter Cardiovasc Interv 2012;79:125-130
- Lee KJ, Seto W, Benson L, Chaturvedi RR. Pharmacokinetics of sirolimus-eluting stents implanted in the neonatal arterial duct. Circ Cardiovasc Interv 2015;8(5):e002233
- Gwellig M, Boshoff D, Dens J, Mertens L, Benson L Stenting the Neonatal Arterial Duct-Dependent Pulmonary Circulation: New Techniques, Better Results. J Am Coll Cardiol 2004; 43:107-112
- Alwi M, Choo K, Latiff H, Kandavello G, Samion H, et al. Initial Results and Medium Term Follow Up of Stent Implantation of Patent Ductus Arteriosus in Duct-Dependent Pulmonary circulation. J Am Coll Cardiol 2004; 44:438-4
- Michel–Behnke I, Aktitürck H, Thul J, et al. Stent implantation in the ductus arteriosus for pulmonary blood supply in congenital heart disease. Catheter Cardiovasc Interv 2004;61(2):242-252
- Schneider M,Zartner P, Sidiropoulos A et al. Stent Implantation of the Arterial Duct in newborns with duct-dependent circulation. Eur Heart J 1998;19:1401-1409
- Celebi A, Yalcin Y, Erdem A, Zeybek C, Akdeniz C, et al. Stent implantation in to the patent ductus arteriosus in cyanotic congenital heart disease with duct dependent or diminished pulmonary circulation. Turk J Pediatr 2007;49: 413-417
- Santoro G, Gaio G, Palladino MT, et al. Stenting of the arterial duct in newborns with duct dependent pulmonary circulation. Heart 2008;94:925-929
- Erdem A, Karaci AR, Saritas T,et al. Evaluation of the efficacy of ductus arteriosus stenting in neonates and infants with severe cyanosis until the later stage palliative surgery or total repair time. Turkish J Thorac Cardiovasc Surg 2011;19(2):192-196
- Santoro G, Capozzi G, Caianiello G, Palladino MT, Marrone C, et al. Pulmonary artery growth after palliation of congenital heart disease with duct dependent pulmonary circulation: arterial duct stenting versus surgical shunt. J Am Coll Cardiol 2009;54:2180-2186
- Sivakumar K, Bhagyavathy A, Coelho R, Satish R, Krishnan P. Longevity of neonatal duct stenting for congenital heart diseases with duct-dependent pulmonary circulation. Congenit Heart Dis 2012;7:526-533
- Celebi A, Kemal I, Orhan M, Kucuk M, Balli S. Stenting of the ductus arteriosus in infants with functionally univentricular heart disease ad ductal dependent pulmonary blood flow: A single-center experience. Cath Cardiovasc Interv 2017;89:699-708
- Rosenthal E, Qureshi SA, Tabatabaie AH, Persaud D, Kakadekar AP et al. Medium-term results of experimental stent implantation into the ductus arteriosus. Am Heart J 1996; 132: 657-663
Conflictos de interés: Ninguno





