Calcificación de la arteria coronaria
La calcificación de la arteria coronaria (CAC), es un proceso de envejecimiento inexorable del ateroma, sería como la cana de la placa ateromatosa. Dicho artículo pretende dar una idea de la fisiopatología, la prevalencia, la clínica y el pronóstico, como así también conocer el diagnóstico y los distintos tipos de tratamiento para cada tipo de placa calcificada.
Con respecto a la fisiopatología, si recordamos el proceso de aterogénesis, el avance de la inflamación produce la apoptosis de las células musculares lisas del vaso (CMLV), y esto lleva a la transformación de macrófagos en osteoblastos, conduciendo a una inevitable mineralización y osificación de la placa; y se la inflamación es recurrente y continua , provoca microcalcificaciones, dando como resultado inestabilidad de la placa y terminar en un síndrome coronario agudo; a la inversa si se logra reducir la inflamación, estas microcalcificaciones se aglomeran como una especie de bolitas de mercurio, provocando la llamada macrocalcificación, una verdadera osificación de la pared coronaria, logrando así la estabilidad de la placa, observándose más en cuadros de anginas estables (Figura 1).
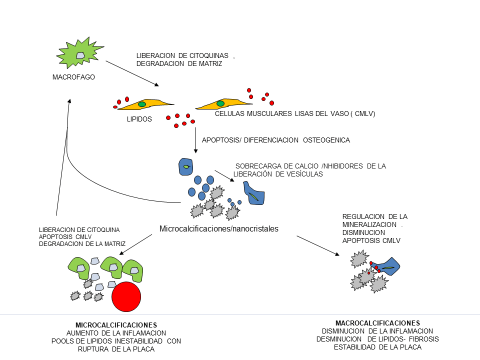
Figura 1. Esquema de los mecanismos de calcificación aterosclerótica y su papel en la estabilidad de la placa. En la aterosclerosis, las señales proinflamatorias, como las lipoproteínas modificadas (rojo), promueven la infiltración de macrófagos en la pared del vaso. Los macrófagos expresan citocinas proinflamatorias que inducen la apoptosis de las células musculares lisas del vaso (CMLV) y la diferenciación osteogénica. La liberación de calcio asociada con las células apoptóticas también puede inducir la liberación de vesículas procalcitogénicas. En ausencia de inhibidores y fagocitosis, los cuerpos y vesículas apoptóticos pueden formar un nido para la calcificación. Las microcalcificaciones iniciales pueden ser proinflamatorias e inducir ciclos adicionales de inflamación. Si la inflamación continúa, a medida que avanza la placa, se inducirá una mayor apoptosis de las CMLV, adelgazamiento de la capa fibrosa y, finalmente, rotura de la placa. Sin embargo, si la inflamación se reduce, la apoptosis de las CMLV es limitada y la placa puede estabilizarse hasta que se inicien más eventos inflamatorios.
La prevalencia de calcificación de la arteria coronaria (CAC) depende de la edad y el sexo y ocurre en ≥90% de los hombres y ≥67% de las mujeres mayores de 70 años. Además, la CAC es más frecuente en caucásicos. La extensión de la CAC se correlaciona fuertemente con el grado de aterosclerosis y la tasa de futuros eventos cardíacos.
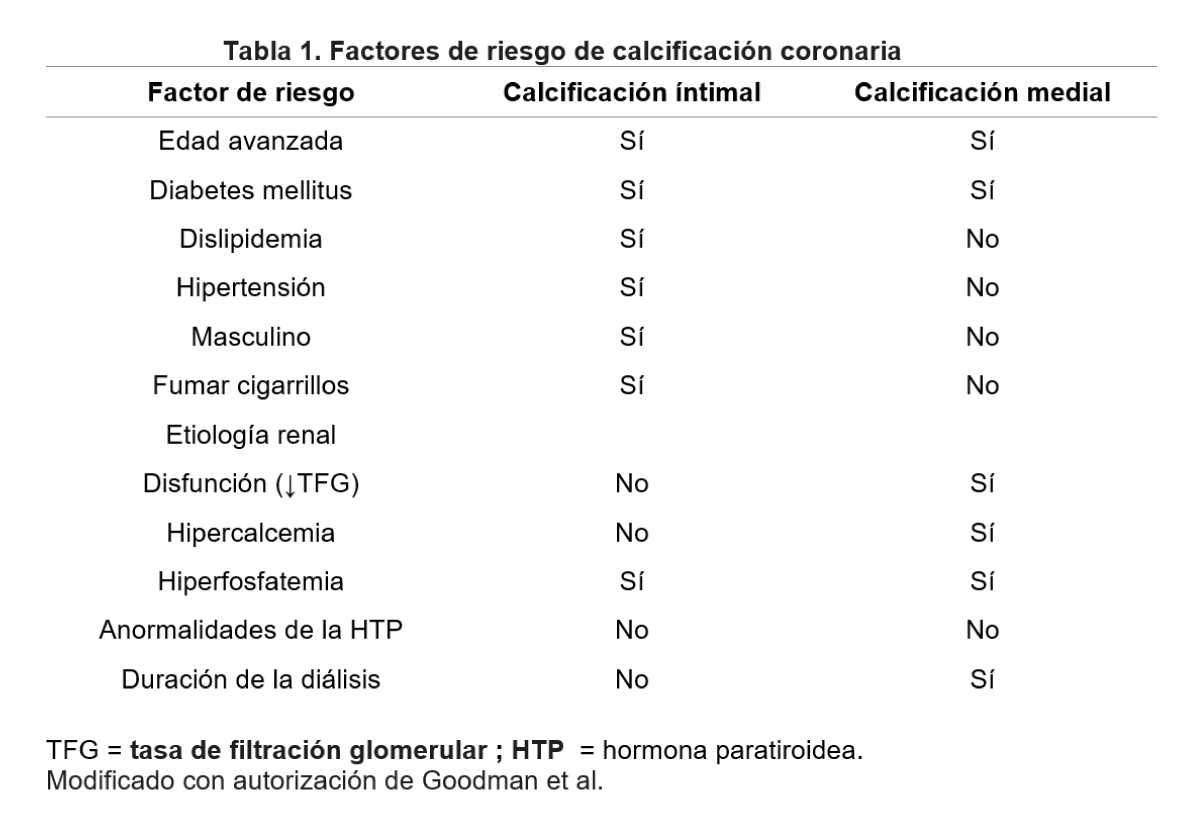
La patogénesis de la CAC y la formación ósea comparten vías comunes y se han identificado factores de riesgo que contribuyen al inicio y la progresión de la CAC (Tabla 1).
La (CAC) produce una distensibilidad vascular reducida, respuestas vasomotoras anormales y alteración de la perfusión miocárdica. La presencia de CAC se asocia con peores resultados en la población general y en pacientes sometidos a revascularización.
La CAC podría heredarse a través de variantes alélicas comunes (p. ej., cromosoma 9p21) y mutaciones raras en el metabolismo del fosfato que también se han asociado con el infarto de miocardio (IM).
Los pacientes con enfermedad renal crónica (ERC) tienen mayor morbimortalidad cardiovascular, en gran medida debido a la presencia de CAC y aterosclerosis acelerada. La hipercalcemia y la hiperfosfatemia promueven la CAC. Además de afectar el equilibrio de solubilidad calcio-fosfato, el fosfato puede estimular la transformación osteocondrogénica de las CMLV. El hiperparatiroidismo secundario en la ERC también es un factor de riesgo de CAC, y la diálisis en personas más jóvenes se asocia con niveles de calcio similares a los de la edad avanzada.
En individuos diabéticos, los productos finales de la glicación avanzada podrían promover la mineralización de los periocitos microvasculares, y un control estricto de la glucemia podría ralentizar la CAC en la diabetes tipo 1 (pero no en la tipo 2).
El activador del receptor de la vía del ligando del factor nuclear kappaB/osteoprotegerina ha surgido como un vínculo potencial entre la osteoporosis y la CAC. Los datos epidemiológicos en humanos sugieren que los niveles más altos de osteoprotegerina están asociados con CAC y eventos cardiovasculares. Se requieren más estudios para dilucidar el papel de esta vía en la patogénesis de CAC.
Curiosamente, la ingestión de una dieta rica en calcio no se ha asociado con la CAC y no se ha observado ninguna relación entre la ingesta de calcio en la dieta y la CAD. Estos datos sugieren que la CAC es el resultado de mecanismos reguladores aberrantes y no de una simple sobrecarga de calcio. Se necesita una mejor comprensión de las vías que contribuyen a la CAC si se quieren desarrollar terapias más efectivas.
Con respecto a la clínica veremos que por lo general el CAC rara vez afectara a jóvenes, mientras que en pacientes de edad media (adultos jóvenes) se manifestará como síndromes coronarios agudos, con enfermedad de uno o dos vasos, en tanto en pacientes ancianos se expresaría como anginas estables, con insuficiencia cardiaca y enfermedad de múltiples vasos (Figura 2).
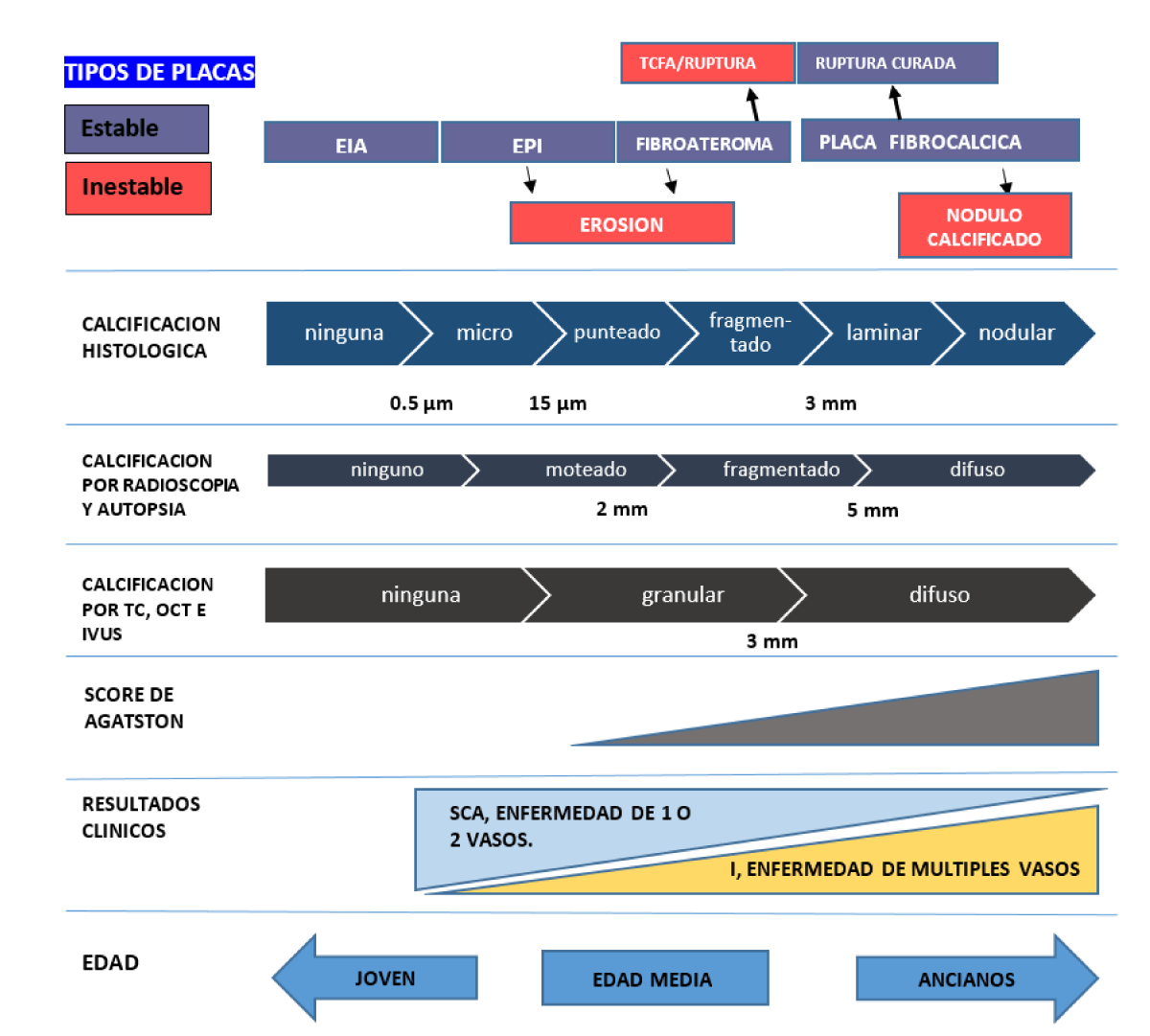
Figura 2. Diagrama conceptual de la calcificación de la arteria coronaria por tipo de placa (estable e inestable), histología, evaluación radiográfica no invasiva (TC, puntuación de Agatston) e invasiva (OCT, IVUS) con resultado clínico basado en la edad de los pacientes (Adapatación modificado de Mori,H et al JACC: Cardiovascular Imaging Volume 11, Issue 1, Enero 2018 , Pág. 127-142).
Para la detección de la CAC existen métodos diagnósticos no invasivos e invasivos:
La tomografía computarizada (TC) es la única prueba no invasiva con alta sensibilidad y especificidad para la detección de calcio y es capaz de cuantificar la calcificación. En estudios observacionales a gran escala, las puntuaciones de calcio basadas en tomografías computarizadas agregaron valor pronóstico para predecir muerte cardíaca e infarto de miocardio, especialmente en pacientes con riesgo intermedio de eventos
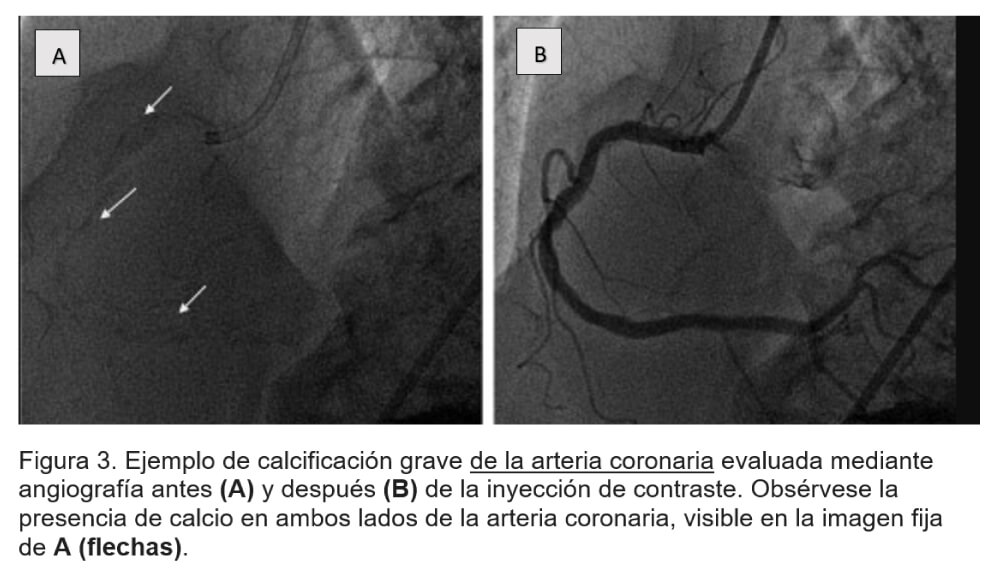
Dentro de los métodos mínimamente invasivos tenemos la fluoroscopia y angiografía (figura 3), la ecografía intracoronaria (IVUS) y la tomografía por coherencia óptica (OCT) (figura 4).
La angiografía coronaria tiene una sensibilidad baja, pero es muy específica (alto valor predictivo positivo). La CAC angiográfica a menudo se clasifica en 3 grupos: ninguna/leve, moderada y grave. La calcificación grave se define más comúnmente como radiopacidades observadas sin movimiento cardíaco antes de la inyección de contraste, que generalmente afectan a ambos lados de la luz arterial, y la calcificación moderada como radiopacidades observadas solo durante el ciclo cardíaco antes de la inyección de contraste.
La ecografía intravascular es sustancialmente más precisa que la angiografía para la detección de CAC, con una sensibilidad del 90% al 100% y una especificidad del 99% al 100%. La característica de la placa calcificada en la IVUS en escala de grises es un eco brillante con sombra acústica, y el grado de calcificación se puede clasificar mediante varias métricas. El arco de calcio se clasifica como ninguno, 1 cuadrante (0° a 90°), 2 cuadrantes (91° a 180°), 3 cuadrantes (181° a 270°) o 4 cuadrantes (271° a 360°). La ubicación del calcio se define como superficial si está presente en la interfaz íntima-luminal, profunda si está dentro del borde medial-adventicia o más cerca de la adventicia que la luz, también se puede identificar el nódulo de calcio. Finalmente, se puede medir la longitud del calcio. Sin embargo, debido a que los ultrasonidos no penetran el calcio, no se puede determinar el espesor del calcio y no se puede calcular el volumen. La ecografía intravascular también puede determinar si el calcio es nodular, superficial o profundo.
Se sabe que la calcificación detectada por IVUS y el sistema de puntuación derivado de IVUS predicen la expansión insuficiente del stent.
La tomografía de coherencia óptima (OCT) basada en luz infrarroja, proporciona imágenes de mayor resolución (10 a 20 μm) que la IVUS en escala de grises (150 a 200 μm), detecta el calcio como áreas de baja intensidad y baja atenuación con bordes nítidos. La sensibilidad (95% a 100%) y especificidad (97% a 100%) de la OCT para CAC rivalizan con la de IVUS. Así, la OCT puede cuantificar la calcificación por el tamaño del arco circunferencial, el espesor, la longitud longitudinal, la profundidad, el área y el volumen tridimensional. Sin embargo, cabe señalar que cuando el calcio se vuelve muy espeso, no se puede detectar el otro lado de la placa. Se ha demostrado que un sistema OCT predice la expansión insuficiente del stent.
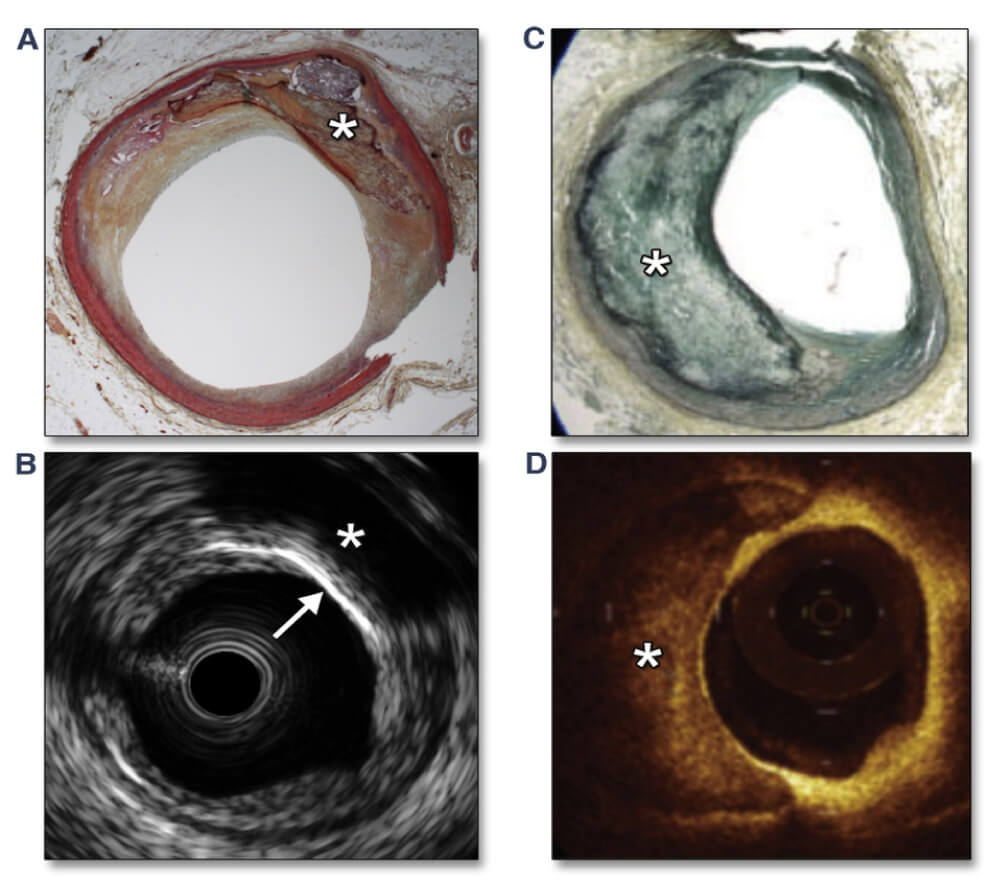
Figura 4. Imágenes IVUS y OCT de calcio en la arteria coronaria
(A y B) Comparación de histopatología e imágenes IVUS de calcio coronario. En la imagen IVUS observe el borde anterior brillante del calcio superficial (más brillante que la adventicia y más cerca de la luz que de la adventicia) (B, flecha blanca) con sombras más profundas (B, asterisco blanco) que corresponde al calcio histopatológico (blanco asterisco). No se puede evaluar el espesor y el área del calcio. (C y D) Comparación de histopatología e imágenes OCT de calcio coronario (D, asterisco blanco). En la imagen OCT, observe la región heterogénea y con señal pobre, con bordes iniciales, finales y laterales claramente delineados. Se puede medir el espesor y el área del calcio.
(A y B) Reimpreso con autorización de Lee et al. (51). (C y D) De Coletta J, Suzuki N, Nascimento BR, et al. Uso de la tomografía de coerência ótica intracoronariana para caracterização precisa da aterosclerose. Arquivos Brasileiros de Cardiología 2010;94:268-272. IVUS = ecografía intravascular; OCT = tomografía de coherencia óptica.
También, en la actualidad, existen score de IVUS (Figura 5) y OCT para definir si una placa cálcica es factible para aterectomía rotacional.
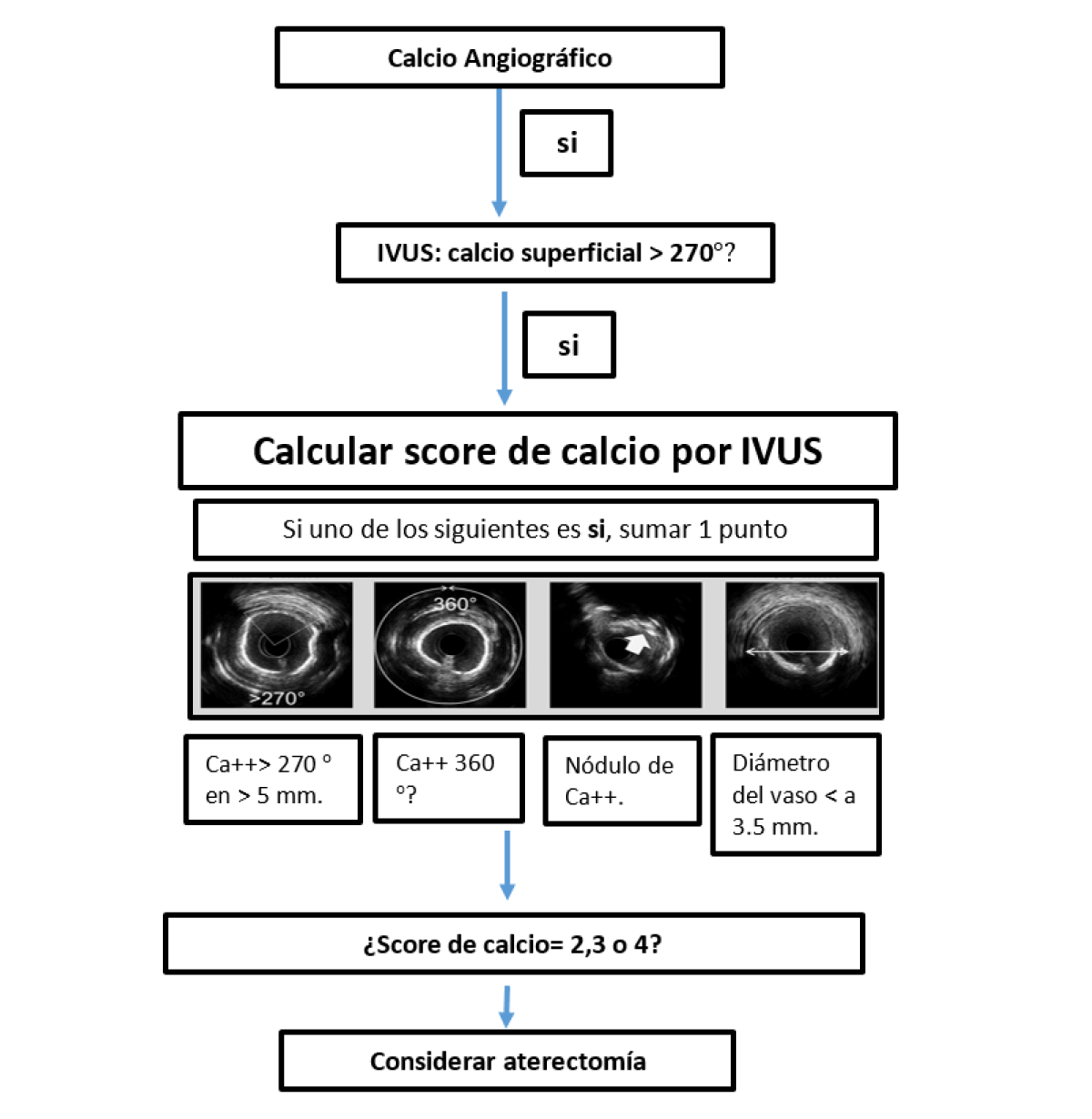
Figura 5. Puntación de calcio derivada de la ecografía coronaria intravascular para predecir expansión del stent en lesiones coronarias severas.
En nuestra experiencia, nos impresiona que con una de las dos técnicas IVUS y OCT es suficiente, con más disponibilidad de la primera en nuestro medio. Además, los últimos consensos recomiendan la utilización de algunas de las dos técnicas después de la preparación de la lesión, asociándose con una mejor expansión del stent.
A la hora de definir qué herramienta utilizar para las lesiones calcificadas, hoy en día deberíamos tomar una conducta -al igual que planificamos un implante valvular aórtico y abarcar la mayor parte de estudios complementarios previo, durante y post procedimiento, para así lograr un éxito en este tipo de angioplastias complejas (figura 6).
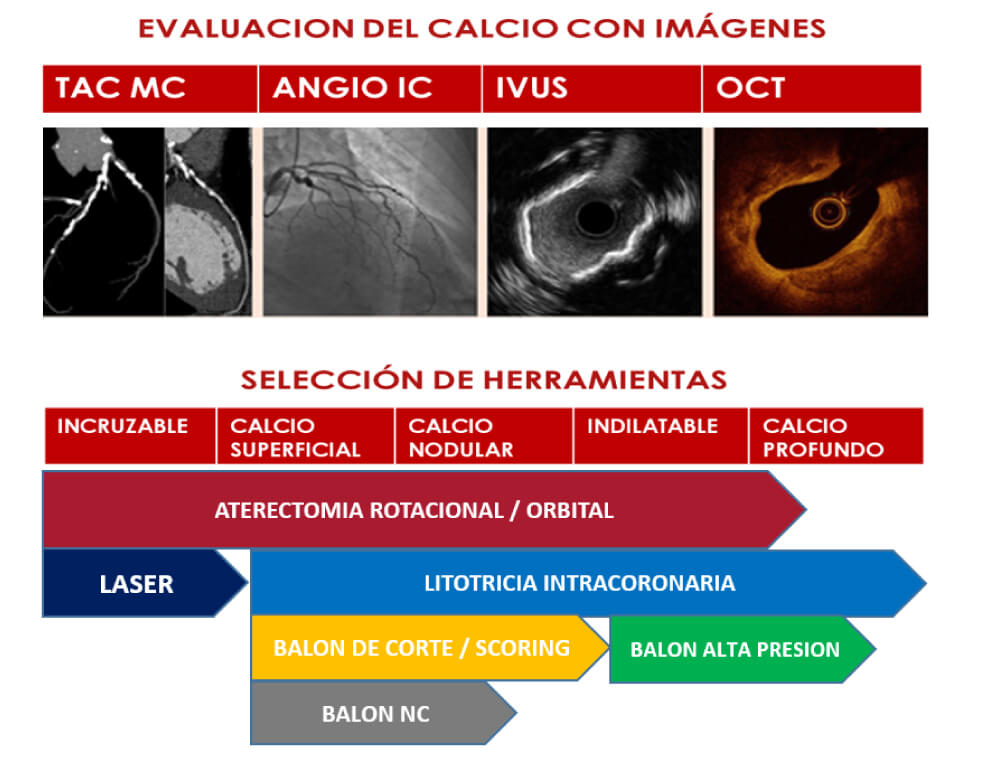
Figura 6. Algoritmo de tratamiento de la placa cálcica (Adaptación del conceso europeo 2023, European Heart Journal, Vol.44, número 41, 1 de noviembre de 2023, págs. 4340–4356). Abreviaciones: IVUS (sonda de ultrasonido vascular intracoronaria), NC (no complaciente), OCT (tomografía de coherencia óptica).
Por último, enfatizar que, dicho capítulo, pretende dar un pantallazo global del abordaje del conocimiento de la placa cálcica e introducirnos en el tema, para luego ser desglosado en próximas editoriales, conociendo con detalles cada una de las herramientas de imágenes, técnicas de modificación de la CAC y resultados.
Bibliografía
Barbato, E. (2023). Estrategias de manejo de estenosis coronarias muy calcificadas: una declaración de consenso clínico de la EAPCI en colaboración con el grupo EURO4C-PCR. European Heart Journal, 44(41), 4340-4356.
Gary S. Mintz, M. (2015). Imágenes intravasculares de la calcificación coronaria y sus implicaciones clínicas. JACC: Imágenes cardiovasculares, 8(4), 461-471.
Mahesh V. Madhavan. (2014). Calcificación de la arteria coronaria : patogenia e implicaciones pronósticas. Journal of the American College of Cardiology ( JACC), 63(17), 1703-1714.
Mori, H. (2018). Calcificación de la arteria coronaria y su progresión : ¿qué significa realmente? JACC: Imágenes cardiovasculares, 11(1), 127-142.
Takehiro Nakahara, P. (2017). Calcificación de la arteria coronaria : del mecanismo a la imagen molecular. JACC: Imágenes cardiovasculares, 10(5), 582-593.
Zhang, M. (2021). Puntuación de calcio derivada de ecografía intravascular para predecir la expansión del stent en lesiones gravemente calcificadas. Circulation Interventions, 14 (10).