Em ausência de tratamento, as cardiopatias congênitas com fluxo pulmonar dependente de canal arterial provocam um deterioro clínico potencialmente letal. Apenas para mencionar algumas, estas lesões incluem a estenose pulmonar crítica, a atresia pulmonar com septo interventricular intacto, a atresia tricúspide e a tetralogia de Fallot e/ou suas variantes (por exemplo, com atresia pulmonar; tipo dupla saída de ventrículo direito). Manter o fluxo pulmonar a partir da circulação sistêmica é primordial nas primeiras horas ou dias de estabelecido o diagnóstico. O manejo inicial, praticamente universal na atualidade, consiste na utilização de prostaglandina E1 (PGE1) intravenosa para evitar a tendência natural de oclusão espontânea do canal, com a qual se consegue definir uma estratégia cirúrgica definitiva (reparação total vs. estratégia paliativa).
Tradicionalmente, a abordagem cirúrgica paliativa consiste na realização de uma fístula sistêmico-pulmonar (FSP), sendo a mais comumente utilizada a conexão entre a artéria subclávia e a artéria pulmonar mediante a colocação de um enxerto protético (tipo Blalock-Taussig modificada). O objetivo é simples: assegurar o fluxo pulmonar e promover o crescimento dos ramos pulmonares, habitualmente hipoplásicos neste tipo de pacientes. Cabe assinalar que embora se trate de um procedimento praticado há mais de sete décadas, a realização de uma FSP se vê limitada por distintos fatores, entre os quais, a experiência institucional e outros que são inerentes ao paciente, como a prematuridade ou o baixo peso. A mortalidade do procedimento é considerável (por volta de 7%), assim como uma significativa morbidade, que beira os 14%.1 Entre outras, as complicações de uma FSP incluem trombose aguda, paralisia do nervo vago ou laríngeo recorrente e quilotórax; além disso, pode causar distorção e crescimento desigual das artérias pulmonares juntamente com a presença de adesões, o que dificulta procedimentos cirúrgicos subsequentes.2,3
O implante de um stent ductal oferece uma alternativa menos invasiva que o procedimento cirúrgico convencional. A primeira descrição do procedimento foi publicada por Gibbs em 1991 como um método não cirúrgico para assegurar o fluxo pulmonar em recém-nascidos e lactentes com circulação dependente do canal (Gibbs).4 Na atualidade, o implante do stent ductal tornou-se uma opção real de tratamento paliativo em um bom número de centros cardiológicos mundo afora. O objetivo desta revisão é detalhar aspectos relevantes do procedimento com particular ênfase na efetividade e na segurança do tratamento.
_
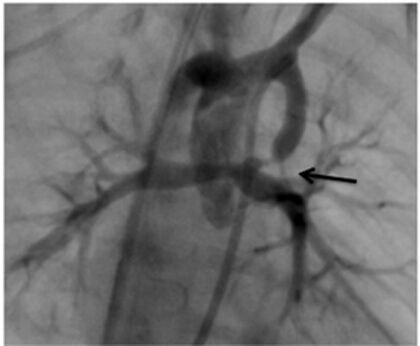
As variantes morfológicas do canal arterial no recém-nascido com circulação pulmonar canal-dependente requerem atenção especial quando se tenta colocar um stent, principalmente naqueles pacientes que não têm uma fonte adicional de fluxo pulmonar. É importante determinar sua forma, tamanho e comprimento, já que ditos fatores determinarão seu trajeto (por exemplo, vertical ou tortuoso) até desembocar na confluência dos ramos pulmonares ou seletivamente na origem de algum deles, habitualmente o esquerdo. Em pacientes com atresia pulmonar, a origem do canal pode ser mais proximal e partir da superfície inferior do arco aórtico. Em alguns casos, o canal pode se originar na artéria subclávia ou no tronco braquiocefálico contralateral e em raras ocasiões pode existir um duplo canal (bilateral) conectando ramos pulmonares não confluentes. Por último, não é infrequente identificar estenose ductal justo antes do ponto de sua inserção com o ramo pulmonar (Figura 1), situação que deverá ser considerada no momento da intervenção.
Não existe um acordo generalizado em relação à suspensão da infusão com PGE1 antes da colocação do stent ductal. Alguns autores se inclinam pela suspensão da infusão uma noite antes do procedimento,5 ao passo que outros decidem fazê-lo minutos antes de iniciar o caso.6 Em ambos os cenários, o objetivo é diminuir o diâmetro do canal para facilitar uma melhor ancoragem do stent à parede do canal. Nossa conduta é variável, embora mais consistente com a suspensão da infusão de PGE1 pelo menos umas 12 horas antes do procedimento. No entanto, em casos de pacientes com cianose acentuada (SaO2 < 75% por oximetria de pulso) nossa preferência é mantê-los sob infusão contínua de PGE1 durante o procedimento e suspendê-la uma vez colocado o stent e aliviada a cianose. O procedimento é realizado sob anestesia geral. É recomendável ter um monitoramento hemodinâmico completo que inclua idealmente uma linha arterial (pressão invasiva) e um cateter venoso central, útil em caso de serem necessários fármacos, inotrópicos ou hemoderivados.
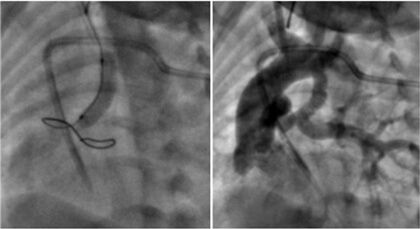
Os métodos de imagem não invasiva feitos antes do procedimento (por exemplo, ecocardiograma ou tomografia computadorizada) orientam na maioria dos casos nossa escolha para definir o ponto de acesso vascular. Quando o canal nasce na aorta descendente e segue um trajeto reto (horizontal), o acesso através da artéria femoral com um introdutor 4 ou 5Fr costuma ser suficiente. Nos casos onde o nascimento do canal se origina no ponto proximal do arco aórtico e segue um trajeto tortuoso, o acesso axilar ou carotídeo proporciona uma rota direta que simplifica a intervenção (Figura 2).7 Nossa conduta envolve o apoio do serviço de cirurgia cardiovascular para realizar a dissecção da artéria carótida e efetuar a punção do vaso sob visão direta. Uma vez estabelecido o acesso vascular, administramos heparina de 50-100UI/kg de peso.
As projeções angiográficas comumente empregadas para visualizar a origem e trajeto do canal incluem uma perspectiva frontal, lateral esquerda (Figura 3) e projeções oblíquas, sejam esquerdas ou direitas com leve grau de angulação craneana. Utilizamos um fio-guia de angioplastia coronariana 0,014” hidrofílico com suporte extra para cruzar o canal e alojá-lo idealmente em um ramo lobar distal do ramo pulmonar (Figura 3B). A colocação do stent pode ser feita na maioria das ocasiões por meio de um introdutor 4Fr ou, em algumas ocasiões, mediante um cateter-guia JR 5Fr. Habitualmente são utilizados stents coronarianos pré-montados não eluidores de fármaco, embora também tenha sido relatada recentemente a utilização destes últimos com resultados interessantes.8 O comprimento do stent deve cobrir a totalidade do canal e deve ser antecipado um encurtamento de 15-20% no momento de realizar sua expansão total. É recomendável que o comprimento do stent seja alguns milímetros maior que o comprimento total do canal e abarque estritamente tanto o cabo pulmonar quanto o aórtico já que segmentos descobertos são propensos à formação de estenose.9 Em pacientes com um peso inferior a 3 kg geralmente são utilizados stents de 3,5 mm de diâmetro, ao passo que em pacientes com mais de 3 kg, é favorável a utilização de stents de 4 mm.5,10,11 Utiliza-se um insuflador para permitir uma dilatação progressiva, sequencial e controlada do balão monitorando as atmosferas assinaladas pelo insuflador e tendo o cuidado de não exceder o ponto máximo de ruptura do balão (Figura 3C). Uma vez alcançada a expansão desejada do stent, o balão deve ser desinflado e retirado com precaução para evitar que o mesmo fique preso e/ou se rompa. Posteriormente são feitas angiografias de controle para verificar a posição do stent dentro do canal e em relação à aorta e aos ramos pulmonares (Figura 3D). Em casos nos quais se identifiquem porções descobertas do canal, pode ser colocado um segundo stent para cobrir a extensão completa do vaso.
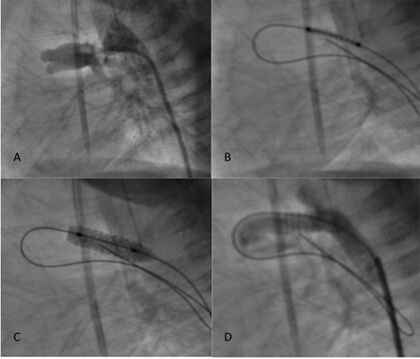
Figura 3.
Técnica de implantação de stent ductal
_
Os cuidados pós-cateterismo devem ser levados a cabo em uma unidade de cuidado intensivo pelo menos durante as primeiras 48 horas. Uma vez alcançada a hemostasia no ponto de acesso vascular iniciamos uma infusão de heparina em uma dose de 10 a 15 UI/kg/hora pelas seguintes 24 horas. Uma vez reestabelecida a alimentação enteral iniciamos antiagregação plaquetária com ácido acetilsalicílico (3-5 mg/kg/dia) uma vez ao dia e de forma indefinida até a reparação cirúrgica em uma etapa subsequente.
_
A tabela mostra os resultados imediatos após a colocação de um stent ductal de acordo com o publicado em algumas das séries disponíveis mais relevantes (incluindo nossa experiência ainda não publicada). Em termos gerais, o resultado imediato é bem-sucedido em aproximadamente 80 a 100% dos casos tomando como critério o notável incremento da saturação arterial uma vez implantado o stent. Em casos que requeiram reintervenção precoce, a razão principal obedece à necessidade de implantar stents adicionais, já que, como se mencionou anteriormente, segmentos do canal sem a cobertura do stent original tendem a se contrair provocando cianose recorrente. A mortalidade precoce (prévia à alta do paciente) gira entre 0 a 10%, com a maioria das séries concluindo que está relacionada com complicações respiratórias ou infeccionas subjacentes e não atribuíveis diretamente ao implante do stent. Nossa mortalidade em menos de 30 dias foi de 28%. Os casos em que a mortalidade esteve diretamente relacionada com o procedimento abrangeram 4 pacientes (3 casos ocorreram desde que adotamos esta estratégia de intervenção em 2005 e podemos atribui-los à curva de aprendizagem do processo).
Vários estudos assinalam a efetividade do stent ductal na promoção do crescimento da árvore vascular pulmonar.16-18 Santoro e colaboradores demonstraram que o fluxo pulmonar consegue se distribuir de maneira uniforme permitindo um desenvolvimento adequado e equilibrado dos ramos pulmonares.16 Dita situação se estende a pacientes com uma fisiologia univentricular que alcançam um tamanho de ramos pulmonares apropriado para um encaminhamento cavopulmonar bidirecional.18
A médio e longo prazo, a perviedade do stent ductal é menor quando comparada com uma FSP. Estudos histológicos experimentais em um início demonstraram que a estenose intrastent é causada pela proliferação neointimal tanto no centro do dispositivo quanto nas bordas aórtica e pulmonar.19 Behnke e colaboradores relataram uma taxa de reestenose de 43% durante o seguimento.11 Outros assinalaram que pode existir obstrução da luz do canal de até 75% seis meses após a intervenção.12 Em termos gerais, os stents ductais demonstraram que mantêm sua perviedade para além dos 6 meses (há relatos de casos de até 36 meses), tempo razoavelmente suficiente para definir na maioria dos casos o projeto cirúrgico individual para cada paciente.
_
|
Referência |
Nº |
Idade (média) |
Peso (kg) |
Efetividade (%) |
Complicações (nº) |
Reintervenção |
Mortalidade (%)(< 30 dias ou antes da alta) |
|
Schneider 1998 (12) |
21 |
13 dias |
3,1 |
100 |
Lesão vascular (2) |
Stent adicional (2) |
10 |
|
Gwellig 2004 (9) |
10 |
6 dias |
3,3 |
100 |
|
Stent adicional (1) |
10 |
|
Michel-Benke 2004 (11) |
21 |
10 dias |
3,3 |
95 |
Migração do stent (3) Trombose aguda (2) |
Stent adicional (3) |
10 |
|
Alwi 2004 (10) |
56 |
2.3 meses |
3,9 |
91 |
Migração do stent (1) |
|
3 |
|
Celebi 2007 (13) |
10 |
3.5 meses |
5,4 |
80 |
|
|
0 |
|
Santoro 2008 (14) |
26 |
15 dias (média) |
3,3 (média) |
92 |
Migração do stent (2) |
|
0 |
|
Schranz 2010 (6) |
27 |
6 dias |
3,2 |
100 |
Migração do stent (1) |
Redilatação (2) Stent adicional (1) |
0 |
|
Erdem 2011(15) |
45 |
66 dias (média) |
4,4 (média) |
93 |
|
|
0 |
|
Sivakumar 2012 (17) |
22 |
13 dias |
|
100 |
|
|
0 |
|
Celebi 2017 (18) |
68 |
26 dias |
3,6 |
95 |
Migração do stent (1) Espasmo ductal (2) |
Stent adicional (2) |
7 |
|
Sandoval 2017 * |
49 |
12 dias |
2,9 |
92 |
Lesão vascular (1) Trombose aguda (2) |
|
28 |
*Série ainda não publicada.
_
Em nosso centro cardiovascular, optamos pelo stent ductal como primeira linha de tratamento em recém-nascidos com cardiopatias congênitas com fluxo pulmonar canal-dependente suscetíveis de estratégias paliativas. Existem, no entanto, algumas condições anatômicas intrínsecas do canal arterial como a tortuosidade excessiva ou o tamanho (amplo) que inclinam nossa decisão a uma FSP tradicional. Por outro lado, a presença de estenose seletiva de um ramo da artéria pulmonar gera um desafio para a implementação de um stent no canal arterial. Em tal contexto, um stent ductal pode exacerbar a estenose preexistente e gerar distorção do ramo da artéria pulmonar. A esse respeito, compartilhamos o assinalado por Alwi e colaboradores no que se refere à presença de estenose de algum ramo da artéria pulmonar (incluindo estenoses ligeiras) como uma contraindicação absoluta em pacientes com um coração univentricular.10
A segurança do procedimento foi amplamente demonstrada e na atualidade a incidência de complicações é baixa. Foram relatadas complicações incluindo lesão vascular no ponto de acesso ou migração ou deslocamento do stent rumo à aorta ou à artéria pulmonar. O espasmo do canal arterial ocorre em menos de 1% dos casos e em geral se apresenta como consequência de excesso de manipulação com o fio-guia para intubar e assegurar a posição dentro do canal. Clinicamente se manifesta por dessaturação progressiva e reter o fio-guia em posição requer uma expedita intervenção para colocar o stent. Do contrário, deve-se iniciar a infusão do PGE1 e trasladar o paciente à sala de cirurgia para realizar uma FSP em caráter de urgência.5
A trombose aguda do stent é uma complicação pouco frequente e ocorre em 1% de nossa experiência de stent ductal no recém-nascido. É uma situação grave que ameaça a vida do paciente e, portanto, requer intervenção imediata. Geralmente é possível suspeitar quando, depois de se ter alcançado um incremento da saturação após a colocação do stent, existe dessaturação de maneira súbita e progressiva. Uma angiografia revela a presença de um trombo parcial ou totalmente oclusivo dentro do stent (Figura 4). É urgente tentar recanalizar o trombo com o fio-guia de angioplastia coronariana 0,014” e avançar um balão coronariano para realizar dilatações repetidas com a finalidade de romper mecanicamente o trombo. A terapia trombolítica pode complementar o manejo em tais casos, a não ser que se considere necessário realizar uma FSP.
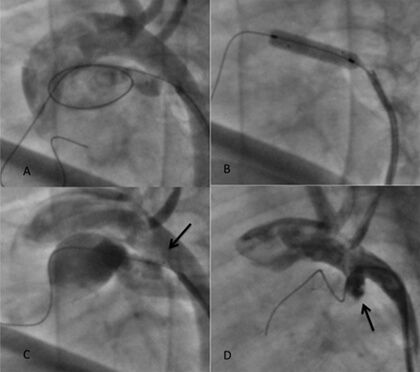
Figura 4.
Trombose aguda de stent
_
A colocação de um stent ductal é um procedimento seguro e efetivo para manter o fluxo pulmonar em pacientes cardiopatas com fluxo pulmonar canal-dependente. A decisão de realizar a intervenção como alternativa à FSP dependerá da preferência e da experiência de cada centro cardiovascular em particular.
Conflitos de interesse: Nenhum