Degeneração de prótese valvar percutânea e durabilidade
O implante percutâneo da valva aórtica, conhecido como TAVI (Transcatheter Aortic Valve Implantation), revolucionou o tratamento da estenose aórtica (EA). Embora seja uma opção terapêutica relativamente nova se comparada à cirurgia de substituição da valva aórtica, nos últimos 15 anos seu uso se estendeu de tal maneira que o TAVI deixou de ser apenas uma alternativa eficaz e segura para se estabelecer como o tratamento de escolha para pacientes com EA severa quando por seu alto risco são inoperáveis ou quando este risco cirúrgico é elevado (indicação I-A segundo guias clínicos americanos e I-B segundo guias europeus). Mais ainda, estudos recentes estenderam a indicação para o tratamento de pacientes com risco intermediário (STS 4-8%), plasmando-o este ano com indicação IIa-B nos guias clínicos americanos e I-B nos europeus.1
Devido ao rápido desenvolvimento tecnológico, ao envelhecimento da população e à ampliação de sua indicação a pacientes com menor risco, espera-se incrementos não só no número absoluto de implantes mas também na proporção de pacientes de menor risco e, por tanto, mais jovens. Em tal contexto e dada a maior expectativa de vida, a durabilidade do implante percutâneo valvar a longo prazo é um ponto crítico na decisão terapêutica entre um tratamento de substituição cirúrgica tradicional ou TAVI.2
A experiência cirúrgica evidenciou que as próteses biológicas têm como ponto fraco sua durabilidade limitada no tempo, sendo a degeneração a principal causa de falência valvar. Tanto é assim que a porcentagem de pacientes sem necessidade de reintervenção é de 94% em 10 anos, mas cai a 53% em 20 anos.3, 4 Apesar do crescente número de publicações, ainda há poucos dados sobre a durabilidade das próteses percutâneas para além dos 5 anos. Além disso, existem inconsistências em sua definição e, portanto, grandes diferenças nas incidências relatadas. Na tabela 1 estão listadas as principais publicações com dados sobre a durabilidade dos TAVI.
A definição de degeneração estrutural da valva do consórcio de pesquisa acadêmica (Valve Academic Reseach Consortium, VARC-2)5 é a utilizada com maior frequência na atualidade:
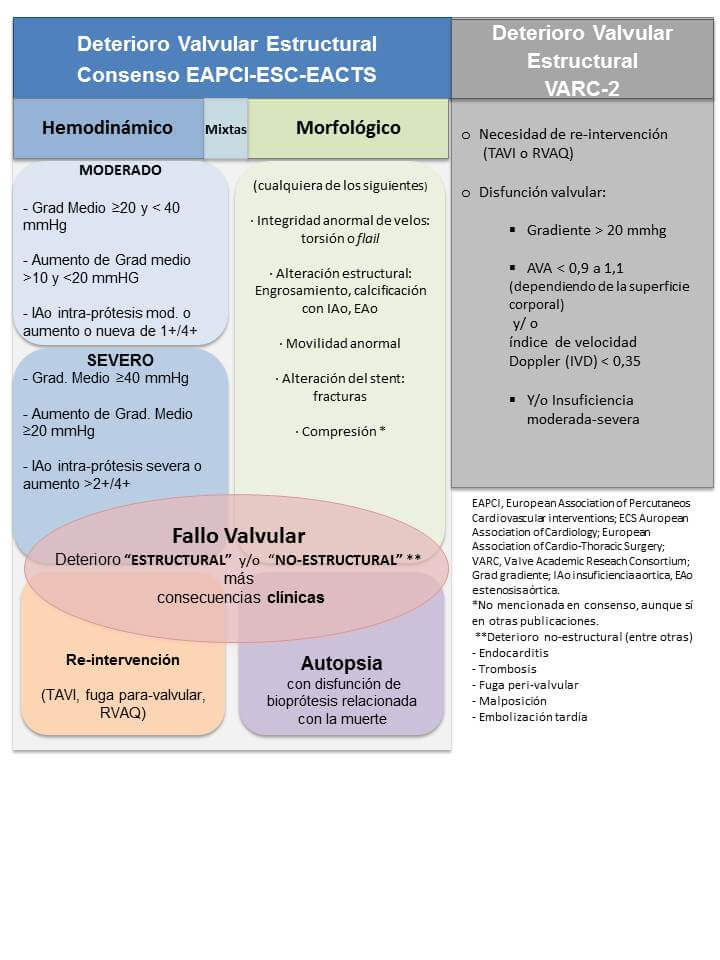
Em uma publicação recente, as sociedades científicas europeias propuseram definições mais precisas deste fenômeno amplo de “falência valvar” para TAVI e cirurgia de substituição da valva aórtica. São descritas duas formas de degeneração valvar: “não estrutural”, que inclui processos extrínsecos (endocardite e trombose, entre outros) e a “degeneração estrutural”, que se refere a mudanças intrínsecas adquiridas na estrutura da prótese. A degeneração estrutural se apresenta, por sua vez, em dois tipos predominantes (embora não excludentes): o “morfológico” e o “hemodinâmico”, este último baseado em mudanças permanentes detectadas por ecocardiografia. Finalmente, o consenso define a “falência da bioprótese” como um conceito integrador entre a degeneração da prótese e sua consequência clínica (sintomas, reintervenção, morte) e se propõe como objetivo para unificar o relato da incidência de eventos.6
No caso das próteses cirúrgicas, a degeneração com calcificação dos véus é a causa mais frequente de falência e poderia também ser o caso nas percutâneas. No entanto, existem diferenças no desenho e na técnica que podem causar diminuição da durabilidade no caso destas últimas. No implante percutâneo, a persistência da valva nativa é um fator chave, já que se associa a calcificação com expansão incorreta da prótese, o que pode condicionar à presença de assimetria e regurgitação, que, por sua vez, gerariam fluxos tumultuosos e degeneração acelerada. Por outro lado, os véus nativos deslocados pela prótese podem alterar os fluxos nos seios de Valsalva provocando assim zonas de maior estancamento, o que predispõe à trombose.7 8 De fato, em um estudo de estresse mecânico, a anatomia ovalada do trato de saída e anel poderia alterar o fluxo e favorecer dano estrutural, o que se agrava em casos de infraexpansão por oversizing.2
As próteses percutâneas mais frequentemente utilizadas se constroem com tecido pericárdico, seja de origem bovina no caso da Edwards-Sapien (Edwards Lifesciences) ou porcina no caso da Core-Valve (Medtronic, Inc.). O tipo de material biológico poderia influir na durabilidade a longo prazo e atualmente é matéria de estudo.9 Outra diferença com relação às próteses cirúrgicas é que os véus são mais finos (0,25 vs. 0,4 mm, aproximadamente) e requer a prensagem no sistema de liberação. Estes dois fatores poderiam condicionar a uma menor resistência ao estresse hemodinâmico.2
As séries observacionais cirúrgicas mostraram que a idade no momento do implante é um dos fatores de maior peso na incidência de degeneração bioprotética, e este conceito poderia ser extrapolado para as próteses percutâneas.10 Isso se deve, por um lado, a uma expectativa de vida maior que daria tempo ao processo progressivo de deterioro, e por outro, a fatores de tipo imunológico e /ou hemodinâmico. Existem outros fatores que predispõem à degeneração, como por exemplo, alterações do metabolismo fosfocálcico, insuficiência renal e fatores de risco cardiovasculares clássicos.4, 3 Outros potenciais preditores de degeneração precoce poderiam ser a ausência de anticoagulação, próteses pequenas (23 mm), procedimentos Valve-in-Valve e obesidade.11 Em uma análise de 5 anos com válvula balão-expansível, a área valvar pequena no momento da alta também foi um preditor independente de DVE.12 Atualmente não se sabe se o tipo de prótese percutânea teria influência na durabilidade a longo prazo.
A formação de trombo nas próteses aórticas percutâneas é um fenômeno heterogêneo que pode ocorrer de forma sintomática (2,8%) ou, mais frequentemente, assintomática com prevalência de até 12%.13,14 A mesma foi observada inicialmente em próteses cirúrgicas, embora sua incidência pareça ser maior nas percutâneas (4 vs. 13%).15 A falta de tratamento anticoagulante se relacionou em vários estudos com a degeneração valvar, ainda que por falhas metodológicas não foi possível estabelecer uma relação causal clara. 11, 16 A trombose poderia diminuir a mobilidade dos véus, o que levaria à superestimação das incidências de DVE. Por outro lado, a própria trombose e consequente alteração no fluxo podem causar aceleração do processo de degeneração dos véus.
A incidência de DVE de próteses percutâneas em seguimentos de até 5 anos é, em geral, muito baixa. Uma metanálise recente que incluiu 8.914 pacientes (entre 2004 e 2015) relatou uma incidência total estimada de 28 por 10.000 pacientes/ano, que equivale a uma incidência de 0,6% em 2 anos.17 Estas cifras elevadas em seguimentos mais longos se devem, provavelmente, ao fato de terem sido usadas próteses de primeira geração, de terem sido pacientes mais idosos e com calcificação acentuada e a fatores tecnológicos menos desenvolvidos. Contudo, existe a possibilidade de que a válvula apresente degeneração a taxas mais elevadas depois de transcorridos 10 anos de seguimento, como ocorre com suas homólogas cirúrgicas.
A DVE pode ser assintomática ou pode se apresentar como insuficiência/estenose de diferentes graus. Caso sejam documentados aumento de gradientes, deve ser valorada a presença de trombose, iniciando tratamento anticoagulante em caso afirmativo. Se esta última for descartada e se for confirmada a DVE, atualmente se considera como primeira linha o tratamento percutâneo.18 Dados preliminares demonstram que procedimentos Valve-in-Valve mostraram ser uma opção viável e com menor risco de complicações pós-operatórias que uma nova cirurgia a curto e médio prazo. No caso de pacientes com TAVI prévio, dado o risco, de início elevado, a toractomia não é a priori uma opção em comparação com um procedimento que tecnicamente não apresenta excessiva complexidade.19 Alguns autores afirmam que a presença de uma válvula poderia facilitar a escolha da nova prótese e do implante. A desvantagem desta técnica é, novamente, a escassez de dados e a durabilidade da segunda prótese, já que em alguns estudos o Valve-in-Valve se associou à degeneração protética. 11 20 21 Outro ponto a levar em consideração é que o acesso aos óstios coronarianos poderia se dificultar em casos de próteses que se estendem até a raiz da aorta.18
Para concluir, os dados atuais permitem afirmar que a durabilidade relatada do TAVI é adequada para a população de maior idade ou de alto ou moderado risco cirúrgico. No entanto, ainda é necessário contar com mais evidência, com estudos detalhados de estrutura e função, bem como com seguimento de mais longo prazo (> 10 anos) para confirmar que a durabilidade da prótese é maior que a expectativa de vida esperada do paciente. Uma vez que dispusermos de dados que confirmem uma funcionalidade adequada a longo prazo, é provável que o TAVI se estenda a pacientes jovens e se estabeleça como uma opção real frente à cirurgia cardíaca neste grupo de pacientes de menor risco.
Tabela 1: Estudos relatando durabilidade valvular a longo prazo
|
Autor/ ano |
Tipo publicação/ estudo |
Número pacientes TAVI1 |
Seguimento (média ou mediana) (anos) |
Tipo Válvula2 |
Incidência DVE |
Definição de DVE |
Tipo DVE / Comentários |
|
Ussia22 2012 |
Coorte, multicêntrica (registro Italiano) |
181 |
3 |
AE |
0% |
Critérios VARC |
Grad. estáveis
|
|
Mack23 2015 |
PARTNER 1 (seguimento de 5 anos) |
384 |
5 |
BE |
0% |
Reintervenção
|
· Grad. e áreas estáveis |
|
Deeb24 2016 |
Randomizado, multicêntrico (Corevalve U.S. Pivotal Trial) |
228 |
3 |
AE |
- 0%
- 9,5%
|
-Estruturais
- Aumento Grad. > 50% |
· Grad e áreas estáveis |
|
Foroutan17 2017 |
Metanálise (13 estudos) |
8.914 |
1,8 a 5 |
BE 56% AE 35% NR 9%
|
0 a 5,5% |
Critérios VARC e Grad > 20mmHg |
· Incidência agrupada de 28/10.000 pac-ano |
|
Gerckens25 2017 |
Coorte prospectiva, multicêntrica |
860 |
3 |
AE |
- 0,9%
- 2,6 % (n=22)
- 9,3%
|
- Relato inicial
- VARC-2 (post-hoc)
- Aumento Grad > 50% (Post-hoc) |
· n 22 (10 EAo, 11 IAo mod-severa, 1 misto) · Reint. 1,2% (n = 10 (4 Qx e 6 TAVI) |
|
Douglas26 2017 |
PARTNER 1A y 1B
|
424 (com ETT seguimento de 5 anos) |
3,1
|
BE |
- 0,5%
- 3,5-49%
|
- Grad. Med. absoluto > 40 mmHg
- VARC-2 de EAo leve |
· Reint. 0,8% (n = 20, maioria regurgitação, 3 IAo, 4 EAo e 1 DVE) |
|
Muratori12 2017 |
Coorte, unicêntrica |
96 |
4,9 (com ETT) 5,4 (clínico) |
BE |
30% |
Engrossamento (> 3 mm), calcificação e movimento anormal de véus |
· Não Reint · Aumento leve-mod. de Grad. · IAo em 45% de DVS |
DVE, degeneração valvar estrutural; BE balão-expansível, AE, autoexpansível; VARC, Valve Academic Research Conseortium; EAo, estenose aórtica; IAo, insuficiência aórtica; Grad., gradientes; Seg., seguimento; Valv., válvulas; NR, não relatado; Pac., pacientes; Reint., reintervenção (cirúrgica ou percutânea); ETT ecocardiograma transtorácico; Mod., moderado; KM Kaplan-Meier.
1: Pacientes disponíveis para análise ecocardiográfica/clínica para o seguimento indicado, exceto na metanálise.
2: BE, balão-expansível; inclui –segundo estudos– Cribier-Edwards TM, Edwards SAPIEN, Edwards SAPIEN-XT). AE, autoexpansível, maioria Medtronic CoreValve.
E-mail: luverapernasetti@yahoo.com.ar
E-mail: rodrigobagur@yahoo.com
Rreferências:
- Barbanti, M., Webb, J. G., Gilard, M. & Capodanno, D. Transcatheter aortic valve implantation in 2017: state of the art. 11–21 (2017).
- Bagur, R., Pibarot, P. & Otto, C. M. Importance of the valve durability-life expectancy ratio in selection of a prosthetic aortic valve. Heart 103, 1756–1759 (2017).
- Arsalan, M. & Walther, T. Durability of prostheses for transcatheter aortic valve implantation. Nat. Rev. Cardiol. 13, 360–367 (2016).
- Côté, N., Pibarot, P. & Clavel, M.-A. Incidence, risk factors, clinical impact, and management of bioprosthesis structural valve degeneration. Curr. Opin. Cardiol. 1 (2017). doi:10.1097/HCO.0000000000000372
- Kappetein, A. P. et al. Updated standardized endpoint de fi nitions for transcatheter aortic valve implantation : the Valve Academic Research Consortium-2 consensus document. Eur. Heart J. 33, 2403–2418 (2012).
- Capodanno, D. et al. Standardized definitions of structural deterioration and valve failure in assessing long-term durability of transcatheter and surgical aortic bioprosthetic valves: a consensus statement from the European Association of Percutaneous Cardiovascular Interven. Eur. J. Cardio-Thoracic Surg. 1–10 (2017). doi:10.1093/ejcts/ezx244
- Ducci, A., Pirisi, F., Tzamtzis, S. & Burriesci, G. Transcatheter aortic valves produce unphysiological flows which may contribute to thromboembolic events: An in-vitro study. J. Biomech. 49, 4080–4089 (2016).
- Midha et al. The Fluid Mechanics of Transcatheter Heart Valve Leaflet Thrombosis in the Neo-Sinus. Circulation 136,1598-1609. (2017).
- Caballero, A., Sulejmani, F., Martin, C., Pham, T. & Sun, W. Evaluation of transcatheter heart valve biomaterials: Biomechanical characterization of bovine and porcine pericardium. J. Mech. Behav. Biomed. Mater. 75, 486–494 (2017).
- Wang, M., Furnary, A. P., Li, H. F. & Grunkemeier, G. L. Bioprosthetic Aortic Valve Durability: A Meta-Regression of Published Studies. Ann. Thorac. Surg. 104, 1080–1087 (2017).
- Del Trigo, M. et al. Incidence, timing, and predictors of valve hemodynamic deterioration after transcatheter aortic valve replacement multicenter registry. J. Am. Coll. Cardiol. 67, 644–655 (2016).
- Muratori, M. et al. Five-year echocardiographic follow-up after TAVI: structural and functional changes of a balloon-expandable prosthetic aortic valve. Eur. Hear. J. - Cardiovasc. Imaging 1–9 (2017). doi:10.1093/ehjci/jex046
- Puri, R., Auffret, V. & Rodés-Cabau, J. Bioprosthetic Valve Thrombosis. J. Am. Coll. Cardiol. 69, 2193–2211 (2017).
- Jose, J. et al. Clinical Bioprosthetic Heart Valve Thrombosis After Transcatheter Aortic Valve Replacement: Incidence, Characteristics, and Treatment Outcomes. JACC Cardiovasc. Interv. 10, 686–697 (2017).
- Chakravarty, T. et al. Subclinical leaflet thrombosis in surgical and transcatheter bioprosthetic aortic valves: an observational study. Lancet 389, 2383–2392 (2017).
- Sondergaard, L. et al. Natural history of subclinical leaflet thrombosis affecting motion in bioprosthetic aortic valves. Eur. Heart J. 1–7 (2017). doi:10.1093/eurheartj/ehx369
- Foroutan, F. et al. Structural valve deterioration after transcatheter aortic valve implantation. Heart 103, 1899–1905 (2017).
- Barbanti, M. & Tamburino, C. Late degeneration of transcatheter aortic valves: Pathogenesis and management. EuroIntervention 12, Y33–Y36 (2016).
- Spaziano, M. et al. Transcatheter Aortic Valve Implantation Versus Re-do Surgery for Failing Surgical Aortic Bioprosthesis: a Multi-Centre Propensity Score Analysis. EuroIntervention 1149–1156 (2017). doi:10.4244/EIJ-D-16-00303
- Durko, A. P., Osnabrugge, R. L. & Kappetein, A. P. Long-term outlook for transcatheter aortic valve replacement. Trends Cardiovasc. Med. 1–10 (2017). doi:10.1016/j.tcm.2017.08.004
- Martin, C. & Sun, W. Transcatheter Valve Underexpansion Limits Leaflet Durability: Implications for Valve-in-Valve Procedures. Ann. Biomed. Eng. 45, 394–404 (2017).
- Ussia, G. P. et al. Transcatheter aortic valve implantation: 3-year outcomes of self-expanding CoreValve prosthesis. Eur. Heart J. 33, 969–976 (2012).
- Mack, M. J. et al. 5-year outcomes of transcatheter aortic valve replacement or surgical aortic valve replacement for high surgical risk patients with aortic stenosis (PARTNER 1): A randomised controlled trial. Lancet 385, 2477–2484 (2015).
- Deeb, G. M. et al. 3-Year Outcomes in High-Risk Patients Who Underwent Surgical or Transcatheter Aortic Valve Replacement. J. Am. Coll. Cardiol. 67, 2565–2574 (2016).
- Gerckens, U. et al. Final 5-year clinical and echocardiographic results for treatment of severe aortic stenosis with a self-expanding bioprosthesis from the ADVANCE Study. Eur. Heart J. 38, 2729–2738 (2017).
- Douglas, P. S. et al. Longitudinal Hemodynamics of Transcatheter and Surgical Aortic Valves in the PARTNER Trial. JAMA Cardiol. 2, 1197 (2017).




