Acceso transapical
La cirugía de reemplazo valvular aórtico con técnica quirúrgica abierta y uso de circulación extracorpórea sigue siendo el tratamiento de elección para la mayoría de los pacientes con estenosis aórtica severa sintomática (1).
En las últimas décadas, el implante percutáneo de válvula aórtica (TAVI) ha surgido como una alternativa probada y efectiva en pacientes de alto riesgo (2). Se ha demostrado la efectividad y seguridad de los implantes valvulares por vía transfemoral (TF) y transapical (TA). Esta última vía surge como una necesidad de acceso en pacientes con vasos ilio-femorales pequeños, tortuosos y/o con enfermedad ateroesclerótica significativa.
Los primeros implantes por vía TA fueron realizados en el año 2004 (3,4) y desde entonces la técnica se ha difundido y estandarizado en el resto del mundo (5,6,7,8). El acceso transapical ofrece una plataforma estable de acceso directo anterógrado y a una distancia de trabajo muy corta de la válvula aórtica nativa. No hay limitaciones de diámetro de los dispositivos lo que lo hace atractivo para otras técnicas en desarrollo.
A continuación, describiremos las etapas de TAVI por vía transapical con válvula Edwards Sapien XT (Edwards Lifesciences), aunque existen también otras prótesis que ofrecen este acceso, como la Symetis Accurate TA® y la JenaValve®.
La selección del paciente y el análisis del caso con el equipo multidisciplinario son claves en el éxito de TAVI, independientemente de la vía de acceso.
Los pacientes de alto riesgo son aquellos con Euroscore ≥ 15% y STS ≥10% o aquellos con otras comorbilidades que dificultan técnicamente la cirugía: aorta en porcelana, cirugía cardíaca previa con puentes permeables, radiación torácica, daño hepático, demencia o fragilidad.
Cateterismo Cardiaco: Evalúa la presencia de enfermedad coronaria crítica y se recomienda tratar con angioplastia lesiones proximales relevantes previo al TAVI. Además, evalúa las proyecciones de trabajo mediante aortografía y permite realizar mediciones hemodinámicas.
Ecocardiografía: Importante para definir severidad de la estenosis aórtica, válvula bicúspide, calcificación de velos y anillo; otras valvulopatías y función ventricular.
Tomografía Axial Computarizada (TAC) de tórax, abdomen y pelvis con contraste y gatillada: Examen principal para definir tamaño de anillo, presencia y distribución del calcio, distancia a ostium coronario. Permite evaluación de aorta en su totalidad y vasos ilio-femorales para definir opciones de acceso y canulación. Identifica el sitio de acceso al ápex y proyecciones de trabajo para el implante.
PASO A PASO
El procedimiento se realiza idealmente en un pabellón híbrido diseñado y equipado con imágenes fijas de alta resolución.
El equipo humano involucrado debe ser: cirujano cardíaco, cardiólogo intervencionista, anestesiólogo cardiovascular con entrenamiento en ecocardiografía transesofágica (ECO TE) o un ecografista cardiovascular. Además deben estar presentes: perfusionista, enfermeras con conocimientos de la cirugía y de hemodinamia, además del tecnólogo de imágenes.
Etapas del procedimiento:
- Identificación del ápex: Utilizando ecocardiografía de superficie y fluoroscopía, se identifica el espacio intercostal 5to o 6to y la posición para la mini toracotomía.
- Acceso arterial y venoso femoral: Vaina 6 FR en arteria femoral con menor calcificación y tortuosidad para avanzar catéter pigtail. Vaina 6 FR en vena femoral. Estos pueden ser utilizados para canulación en situación de emergencia.
- Definir proyección de trabajo: Basado en TAC y aortografía previa, se deben confirmar los ángulos de proyección en que las bases de los tres senos de valsalva se encuentren alineadas.
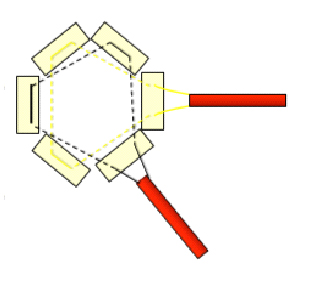
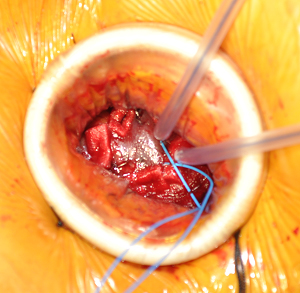
- Mini toracotomía: Incisión de 3 a 5 cm en posición definida previamente. Se abre espacio intercostal y palpa digitalmente el ápex. Se abre pericardio y suspende con puntos de tracción. Se inserta retractor de tejido blando para optimizar exposición (Alexis Retractor®, Applied Medical Corp). Puede ser necesario utilizar retractor intercostal pequeño. Se debe identificar la arteria descendente anterior y ubicar la zona muscular de porción anterolateral del ápex, evitando el tejido graso. Para confirmar la posición ideal de acceso, se palpa digitalmente y visualiza con ECO TE en eje largo, la zona de indentación que debe ser lateral y craneal al ápex anatómico del ventrículo izquierdo (VI). Luego se realizan dos suturas concéntricas triangulares con Prolene 3-0 MH Ethicon apoyadas sobre pledgets de teflón (Figura 1). Éstas deben ser pasadas profundas en la pared del VI dejando una zona de 20-25 mm en su interior para la inserción del sistema. Luego se pasan por torniquetes. En esta misma zona, se implantan cables de marcapaso epicárdicos en porciones opuestas de la circunferencia, evitando contacto ente ellos (Figura 2)
- Heparinización sistémica: 100 U/kg para lograr ACT > 300 seg.
- Punción del Apex: Se punciona el centro de la circunferencia con aguja 14 y se avanza bajo visión fluoroscópica hasta obtener flujo pulsátil de sangre arterial, luego se avanza guía blanda 0,035” hasta aorta ascendente. Visualización con ECO TE debe confirmar el paso a través de la válvula aórtica y descartar compromiso de aparato subvalvular mitral. Utilizando catéter Judkins Der® (JR), se avanza la guía hasta posicionarse en la aorta abdominal. Luego se intercambia por una guía Extra Stiff® 260 cm/0,035”. Se avanza introductor Ascendra® y posiciona en cavidad ventricular 2 a 3 cm.
- Valvuloplastía Aórtica: Se introduce balón del sistema (3 cm, 20 cc) y posiciona en válvula aórtica. Bajo estimulación con marcapaso a 140-180/min se realiza valvuloplastía aórtica. Esta etapa es muy importante, ya que permite una prueba de la secuencia y coordinación del equipo que luego se utilizará en el implante. La inyección de contraste a través de catéter pigtail durante la valvuloplastía permite evaluar el tamaño de la raíz aórtica y comportamiento de los velos valvulares calcificados y su relación con los ostium coronarios.
- Posicionamiento de la válvula e implante: Se avanza la válvula a través de introductor bajo visión fluoroscópica hasta posicionarla dentro del anillo aórtico, luego se retira el pusher del sistema. La posición ideal de la prótesis Sapien® es 1/3 del stent bajo nivel de los senos de valsalva y 2/3 sobre dicho plano. En estos momentos, se deben repetir las inyecciones de contraste en la raíz aórtica para asegurar dicha posición y realizar ajustes. Se debe complementar con visión del ECO TE que permite ubicar el extremo ventricular del stent en relación a la porción fibrosa mitro-aórtica. La zona de “bisagra” del velo mitral anterior es el lugar ideal para la ubicación del extremo proximal del stent en la región sub anular. Una vez definida la posición ideal, se inicia la secuencia del implante que debe ser dirigida por el primer operador que define funciones de cada integrante. Se inicia el marcapaso 180 x min èevidencia captura, caída de presión arterial <50 mmHg, ausencia de eyección èinyección de contraste para confirmar posición èinicia insuflado lento, ajustes mínimos si es necesario, insuflación completa 5-6 seg èdesinflado rápido y se detiene el marcapaso. Estabilización hemodinámica.
- Evaluación ecocardiografía: Se evalúa ubicación y función valvular, presencia de regurgitación para-valvular.
- Cierre quirúrgico del ápex: Bajo estimulación con marcapaso rápido y una presión arterial < 50mmHg, se retira el introductor y anudan suturas. Se revierte heparinización, afronta pericardio e instala drenaje a cavidad pleural. Se infiltra espacio intercostal con bupivacaína. Se cierra la incisión por planos.
Nuestra experiencia con este acceso incluye 25 pacientes, 20 aórticos, 4 valve in valve (ViV) mitrales y uno doble ViV. Edad promedio 82 años (70-91), STS y Euroscore promedio de 11,5 y 25,6 respectivamente. 100% de los implantes fueron exitosos y no hubo mortalidad perioperatoria. En seguimiento promedio de 27 meses, un 80% (20 pac) se encuentran vivos.
Figuras
|
Figura 1. Doble sutura triangular concéntrica de Prolene 3-0 MH apoyado sobre pledgets de teflón. |
|
Figura 2. La imagen muestra la zona apical preparada para la punción. Se observa doble sutura sobre pledgets de teflón, torniquetes y cables epicárdicos. |
Bibliografía
- Nishimura RA, Otto CM, Carabello BA, Erwin JP, Guyton RA, O 'Gara PT, Ruiz CE, Skubas N, Sorajja P. 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease: Executive Summary J Am Coll Cardiol. 2014,63; (22):e57-e185.
- Leon MB, Smith CR, Mack M, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med 2010; 363:1597-607.
- Lichtenstein SV, Cheung A, Ye J, et al. Transapical transcatheter aortic valve implantation in humans: initial clinical experience. Circulation 2006;114:591-596
- Holzey DM, Hänsig M, Walther T, Seeburger J, Misfeld M, Linke A, Borger MA, Mohr FW. Transapical aortic valve implantation- The Leipzig experience. Ann Cardiothorac Surg 2012;1(2):129-137.
- Stähli BE, Altwegg L. Transapical transcatheter aortic valve implantation: the front door approach captures the world. Cardiovascular Diagnosis and Therapy. 2012;2(4):E4-E6.
- Walther T, Kempfert J, Rastan A, et al. Transapical aortic valve implantation at 3 years. J Thorac Cardiovasc Surg 2012;143:326-31.
- Cheung A. Lichtenstein KM. Ilustrated techniques for transapical aortic valve implantation. Ann Cardiothorac Surg 2012;1(2):231-239.
- Walther T, Dewey T, Borger MA. Et al. Transapical aortic valve implantation: step by step. Ann Thorac Surg 2009;87:276-83.
Conflicto de interés: Dr. Michael Howard es Proctor de Edwards Lifesciences para implante de válvula Edwards Sapien XT por vía transapical.



