A cirurgia de substituição valvar aórtica com técnica cirúrgica aberta e uso de circulação extracorpórea continua sendo o tratamento de eleição para a maioria dos pacientes com estenose aórtica severa sintomática[1].
Nas últimas décadas, o implante percutâneo da valva aórtica (TAVI) surgiu como alternativa comprovada e efetiva em pacientes de alto risco[2]. Demonstrou-se a efetividade e segurança dos implantes valvares por via transfemoral (TF) e transapical (TA). Esta última via surge como uma necessidade de acesso em pacientes com vasos ílio-femorais pequenos, tortuosos e/ou com doença aterosclerótica significativa.
Os primeiros implantes por via TA foram realizados em 2004[3,4] e desde então a técnica se difundiu e se padronizou em todo o mundo[5,6,7,8]. O acesso transapical oferece uma plataforma estável de acesso direto anterógrado e a uma distância de trabalho muito curta da valva aórtica nativa. Não há limitações de diâmetro dos dispositivos, o que torna o procedimento atraente para outras técnicas em desenvolvimento.
A seguir, descreveremos as etapas do TAVI por via transapical com válvula Edwards Sapien XT (Edward Lifesciences), embora existam também outras próteses que oferecem este acesso, como a Symetis Accurate TA® e a JenaValve®.
A seleção do paciente e a análise do caso com a equipe multidisciplinar são cruciais para o sucesso do TAVI, independentemente da via de acesso.
Os pacientes de alto risco são aqueles com EuroScore ≥ 15% e STS ≥ 10% ou aqueles com outras comorbidades que dificultam tecnicamente a cirurgia: aorta em porcelana, cirurgia cardíaca prévia com pontes pérvias, radiação torácica, dano hepático, demência ou fragilidade.
Cateterismo Cardíaco: avalia a presença de doença coronariana crítica e recomenda tratar com angioplastia lesões proximais relevantes previamente ao TAVI. Ademais, avalia as projeções de trabalho mediante aortografia e permite realizar medições hemodinâmicas.
Ecocardiografia: importante para definir severidade da estenose aórtica, valva bicúspide, calcificação de véus e anéis; outras valvoplastias e função ventricular.
Tomografia Axial Computadorizada (TAC) de tórax, abdómen e pélvis com contraste e gatilhada: exame principal para definir tamanho de anel, presença e distribuição do cálcio, distância a óstio coronariano. Permite avaliação de aorta em sua totalidade e vasos ílio-femorais para definir opções de acesso e canulação. Identifica o local de acesso ao ápex e projeções de trabalho para o implante.
PASSO A PASSO
O procedimento se realiza idealmente em um pavilhão híbrido desenhado e equipado com imagens fixas de alta resolução.
A equipe humana envolvida deve ser: cirurgião cardíaco, cardiologista intervencionista, anestesista cardiovascular com treinamento em ecocardiografia transesofágica (ECO TE) ou um ecografista cardiovascular. Ademais, devem estar presentes: perfusionsita, enfermeiros com conhecimentos da cirurgia e de hemodinâmica, além de um tecnólogo de imagens.
Etapas do procedimento:
- Identificação do ápex: utilizando ecocardiografia de superfície e fluoroscopia, identifica-se o 5º ou 6º espaço intercostal e a posição para a minitoracotomia.
- Acesso arterial e venoso femoral: bainha 6 FR em artéria femoral com menor calcificação e tortuosidade para impelir cateter pigtail. Bainha 6 FR em veia femoral. Estes acessos podem ser utilizados para canulação em situação de emergência.
- Definir projeção de trabalho: baseado em TAC e aortografia prévia, devem ser confirmados os ângulos de projeção nos quais as bases dos três seios de Valsalva se encontrem alinhadas.
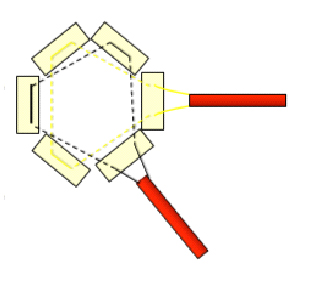
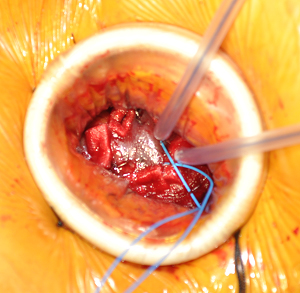
- Minitoracotomia: Incisão de 3 a 5 cm em posição definida previamente. Abre-se espaço intercostal e apalpa-se digitalmente o ápex. Abre-se pericárdio e suspende-se com pontos de tração. Insere-se retrator de tecido mole para otimizar exposição (Alexis Retractor®, Applied Medical Corp). Pode ser necessário utilizar retrator intercostal pequeno. Deve-se identificar a artéria descendente anterior e localizar a zona muscular de porção anterolateral do ápex, evitando o tecido adiposo. Para confirmar a posição ideal de acesso, apalpa-se digitalmente e visualiza-se com ECO TE no eixo longo a zona de indentação que deve ser lateral ao ápex anatômico do ventrículo esquerdo (VI). Depois são feitas duas suturas concêntricas triangulares com Prolene 3-0 MH Ethicon apoiadas sobre pledgets de teflon (Figura 1). As mesmas devem ser passadas profundamente na parede do VI deixando uma área de 20-25 mm em seu interior para a inserção do sistema. Em seguida são passadas por torniquetes. Nessa mesma zona, implantam-se cabos de marca-passo epicárdicos em posições opostas da circunferência, evitando o contato entre eles (Figura 2).
- Heparinização sistêmica: 100 U/kg para lograr ACT > 300 segs.
- Punção do Ápex: posiciona-se o centro da circunferência com agulha 14 e impele-se sob visualização fluoroscópica até obter fluxo pulsátil de sangue arterial. Depois impele-se guia mole 0,035” até a aorta ascendente. Visualização com ECO TE deve confirmar a passagem através da valva aórtica e descartar comprometimento de aparato subvalvar mitral. Utilizando cateter Judkins Der® (JR), impele-se guia até que o mesmo se posicione na aorta abdominal. Depois intercambia-se um guia Extra Stiff® 260 cm/0,035”. Impele-se introdutor Ascendra® e posiciona-se em cavidade ventricular 2 a 3 cm.
- Valvoplastia Aórtica: introduz-se balão do sistema (3 cm, 20 cc), posicionando-o em valva aórtica. Sob estimulação com marca-passo a 140-180/min realiza-se valvoplastia aórtica. Esta etapa é muito importante, já que permite um teste da sequência e coordenação do equipamento que depois será utilizado no implante. A injeção de contraste através de cateter pigtail durante a valvoplastia permite avaliar o tamanho da raiz aórtica e o comportamento dos véus valvares calcificados e sua relação com os óstios coronarianos.
- Posicionamento da válvula e implante: avança-se a válvula através de introdutor sob visualização fluoroscópica até seu posicionamento dentro do anel aórtico. Depois retira-se o pusher do sistema. A posição ideal da prótese Sapien® é 1/3 do stent sob o nível dos seios de Valsalva e 2/3 sobre dito plano. Nesse momento devem ser repetidas as injeções de contraste na raiz aórtica para assegurar dita posição e realizar ajustes. Deve-se complementar com visualização do ECO TE, que permite localizar o extremo ventricular do stent em relação à porção fibrosa mitro-aórtica. A zona de “dobradiça” do véu mitral anterior é o lugar ideal para a localização do extremo proximal do stent na região subanular. Uma vez definida a posição ideal, inicia-se a sequência do implante que deve ser dirigida pelo primeiro operador que define as funções de cada integrante. Inicia-se o marca-passo 180 x min èevidencia captura, queda de pressão arterial < 50 mmHg, ausência de ejeção èinjeção de contraste para confirmar posição èinicia-se insuflação lenta, ajustes mínimos se for necessário, insuflação completa 5-6 segundos èdesinflação rápida e detenção do marca-passo. Estabilização hemodinâmica.
- Avaliação ecocardiografia: avalia-se localização e função valvar, presença de regurgitação paravalvar.
- Oclusão cirúrgica do ápex: sob estimulação com marca-passo rápido e uma pressão arterial < 50 mmHg, retira-se o introdutor e atam-se suturas. Reverte-se heparinização, afronta-se pericárdio e instala-se drenagem em cavidade pleural. Infiltra-se espaço intercostal com bupivacaína. Oclui-se a incisão por planos.
Nossa experiência com este acesso inclui 25 pacientes, 20 aórticos, 4 valve in valve (ViV) mitrais e um duplo ViV. Idade média de 82 anos (70-91), STS e EuroScore médio de 11,5 e 25,6, respectivamente. 100% dos implantes foram bem-sucedidos e não houve mortalidade perioperatória. Em seguimento médio de 27 meses, 80% (20 pacientes) estão vivos.
Figuras
Figura 1. Dupla sutura triangular concêntrica de Prolene 3-0 MH apoiada sobre pledgets de teflon.
Figura 2. A imagem mostra a zona apical preparada para a punção. Observa-se dupla sutura sobre pledgets de teflon, torniquetes e cabos epicárdicos.
Bibliografia
- Nishimura RA, Otto CM, Carabello BA, Erwin JP, Guyton RA, O'Gara PT, Ruiz CE, Skubas N, Sorajja P. 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease: Executive Summary J Am Coll Cardiol. 2014,63; (22):e57-e185.
- Leon MB, Smith CR, Mack M, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med 2010; 363:1597-607.
- Lichtenstein SV, Cheung A, Ye J, et al. Transapical transcatheter aortic valve implantation in humans: initial clinical experience. Circulation 2006;114:591-596
- Holzey DM, Hänsig M, Walther T, Seeburger J, Misfeld M, Linke A, Borger MA, Mohr FW. Transapical aortic valve implantation- The Leipzig experience. Ann Cardiothorac Surg 2012;1(2):129-137.
- Stähli BE, Altwegg L. Transapical transcatheter aortic valve implantation: the front door approach captures the world. Cardiovascular Diagnosis and Therapy. 2012;2(4):E4-E6.
- Walther T, Kempfert J, Rastan A, et al. Transapical aortic valve implantation at 3 years. J Thorac Cardiovasc Surg 2012;143:326-31.
- Cheung A. Lichtenstein KM. Ilustrated techniques for transapical aortic valve implantation. Ann Cardiothorac Surg 2012;1(2):231-239.
- Walther T, Dewey T, Borger MA. Et al. Transapical aortic valve implantation: step by step. Ann Thorac Surg 2009;87:276-83.
Conflito de interesse: Dr. Michael Howard é Proctor da Edwards Lifesciences para implante de válvula Edwards Sapien XT por via transapical.