Técnica Paso a Paso de cierre percutáneo, a raíz de un Caso Clínico
Introducción:
El foramen oval permeable (FOP) es una lesión cardíaca congénita que con frecuencia persiste en la edad adulta, con una prevalencia entre el 25-30% (1). Aunque la mayoría de los pacientes con FOP son asintomáticos, una variedad de manifestaciones clínicas pueden estar asociadas, sobre todo el accidente cerebrovascular criptogénico (ACC), particularmente en aquellos menores de 55 años en los que es más probable que el FOP desempeñe un papel causal. El defecto puede servir como una vía para el tránsito venoso a arterial de émbolos (émbolos paradójicos) a través de la comunicación de derecha a izquierda cuando la presión en la aurícula derecha (AD) excede la de la aurícula izquierda (AI). Se produce un gradiente transitorio de derecha a izquierda en individuos normales durante la sístole ventricular temprana y con la maniobra de Valsalva (por ejemplo, esfuerzo para defecar, toser, levantar o empujar objetos pesados) (2,3,4,5).
El caso a continuación se trata de un paciente que presentó ACC, donde se le encontró un FOP como la causa de su cuadro, con anatomía favorable para cierre percutáneo del mismo.
Caso Clínico:
Se trata de un paciente masculino de 40 años, sin antecedentes de importancia que presentó un cuadro sincopal con trauma cráneo cefálico (TCE) leve. Dos días después presenta cuadro de cefalea intensa holocraneana acompañado de vómito en proyectil. Acude a emergencia donde es valorado por neurología quien realiza una resonancia magnética de cerebro con hallazgos compatibles con hemorragia subaracnoidea (HSA) laminar frontal e infarto lacunar subagudo en tubérculo cuadrigémino izquierdo. El paciente durante la hospitalización se mantuvo estable y en observación, decidiéndose realizar estudios complementarios para descubrir el origen del infarto lacunar bajo la clasificación TOAST (5), mientras que la HSA se la interpreta secundaria al TCE.
Por lo que se realizan los siguientes estudios:
Se trata de un paciente masculino de 40 años, sin antecedentes de importancia que presentó un cuadro sincopal con trauma cráneo cefálico (TCE) leve. Dos días después presenta cuadro de cefalea intensa holocraneana acompañado de vómito en proyectil. Acude a emergencia donde es valorado por neurología quien realiza una resonancia magnética de cerebro con hallazgos compatibles con hemorragia subaracnoidea (HSA) laminar frontal e infarto lacunar subagudo en tubérculo cuadrigémino izquierdo. El paciente durante la hospitalización se mantuvo estable y en observación, decidiéndose realizar estudios complementarios para descubrir el origen del infarto lacunar bajo la clasificación TOAST (5), mientras que la HSA se la interpreta secundaria al TCE.
- Angioresonancia cerebral simple: disminución del calibre de la arteria vertebral derecha en comparación con la contralateral, hemorragia subaracnoidea bifrontal, colecciones hemáticas subdurales fronto parietales bilaterales, surcos de la convexidad prominentes.
- Angioresonancia de cuello: vertebrales asimétricas, la derecha presenta un diámetro menor en todo el trayecto.
- Eco Doppler carotídeo: estudio de vasos carotíeos y vertebrales dentro de parámetros normales para la edad, vena yugular y subclavia con flujo conservado sin evidencia de trombosis en forma bilateral.
- Pruebas de hipercoagubilidad, las cuales son negativas.
- Eco Doppler dos extremidades arterias y venas: Doppler color del sistema venoso profundo y superficial de miembros inferiores sin evidencia de trombosis.
- Ecocardiograma Doppler: donde se visualiza un septum interauricular adelgazado, laxo e hiperdinámico. Se decide inyectar suero salino agitado desde la vena cefálica derecha, evidenciándose paso espontáneo de contraste en gran cantidad, con un Qp:Qs normal y el resto de parámetros dentro de límites de normalidad. Con este hallazgo, se decide realizar un ecocardiograma transesofágico (ETE) para definir las características del septum interauricular.
- ETE bidemensional (ETE2D): defecto del tabique interauricular foramen oval permeable (favorable para cierre percutáneo), cavidades cardiacas de tamaño y función conservadas. FEVI 68%.
El paciente evoluciona de buena manera, razón por la cual se decide dar el alta hospitalaria y realizar un HOLTER de arritmias de 7 días por ambulatorio, el mismo que fue negativo para arritmias.
Con el resultado de los exámenes, se llega al diagnóstico de embolia paradojal, por lo que se lo cataloga como un accidente cerebrovascular criptogénico con indicación de cierre del FOP de manera percutánea. Debido a que presenta una HSA, se consideró una espera de 5 meses hasta realizar un nuevo control con TAC para verificar que el HSA se haya reabsorbido. Con esto, neurología nos autorizó el cierre percutáneo del FOP y el uso de doble antiagregación con aspirina y clopidogrel por mínimo de 6 meses.
Una vez que han pasado los tres meses y con autorización de neurología se decide el cierre del FOP de forma percutánea.
En todos los casos, para la planificación de un FOP necesitamos las características anatómicas (6) del mismo para definir si es viable su cierre percutáneo valorando su ubicación, características y valoración de los bordes. En este caso la descripción del defecto es el siguiente, por medio de un ETE Tridimensional (ETE3D) (Figura 1a y 1b):
Septum interauricular laxo y que en el cuadrante antero superior se observa excursión amplia del mismo, con evidencia de Doppler color de flujo bidireccional (shunt de izquierda a derecha), inconstante (variable con la respiración). Con paso espontáneo de suero salino agitado en gran cantidad. Contorno de 12 cm x 3.1 mm, Área de 33 mm2.
Borde antero superior (Aorta): < 5 mm.
Borde antero inferior (valvula tricuspide): > 5mm.
Borde postero inferior (vena cava inferior): > 5mm.
Borde posterior: > 5mm.
Borde postero superior (vena cava superior): > 5mm
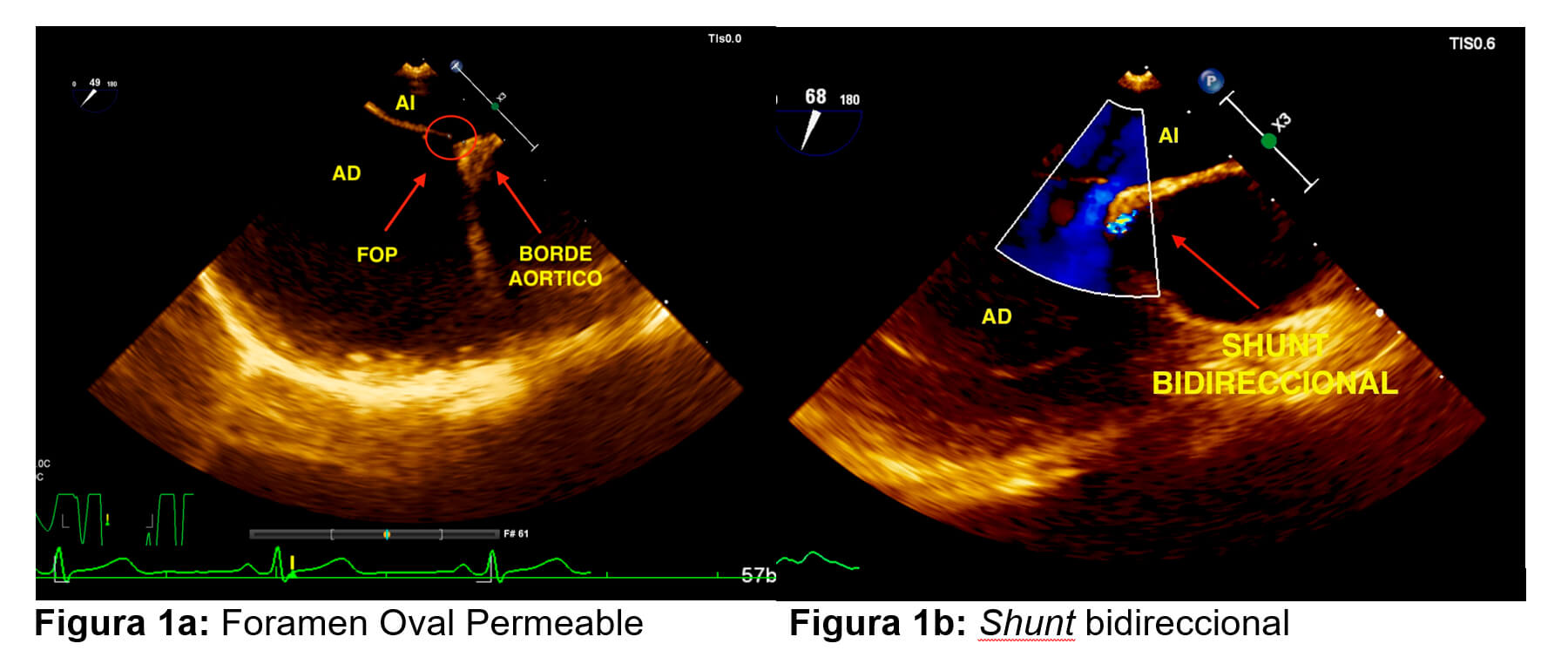
Se discute el caso con el equipo de hemodinamia estructural y se evalúa los bordes del defecto llegando a la conclusión de que tiene bordes óptimos para cierre percutáneo con oclusor. En conjunto con neuróloga de cabecera se toma la decisión en conjunto, del cierre percutáneo del FOP.
Estrategia:
Con el ETE (2D y 3D) diagnóstico y las medidas del FOP se planifica el cierre del mismo con un dispositivo Figulla Flex II PFO de 23/25 mm (Occlutech). En nuestra experiencia vale la pena siempre tener dos dispositivos extras, uno de menor y otro de diámetro superior al planificado, en caso de que el dispositivo de elección previa no se quede fijo en el defecto.
Se planifica el procedimiento con anestesia general e intubación orotraqueal y bajo guía de ETE. Previa asepsia y antisepsia de la región inguinal derecha, se colocan campos quirúrgicos, se infiltra la zona con Xylocaína al 2%. Con técnica de Seldinger y bajo guía de ultrasonido se punciona la vena femoral derecha y se canula con un introductor 5Fr. Se realiza un corte de bisturí a nivel de la piel de aproximadamente 3 mm, para que entre sin problema la vaina del FOP de 9Fr. Se avanza una cuerda guía metálica teflonada de 0.035" x 260cm hacia cava superior, sobre la misma, se introduce un catéter multipropósito (MP) 5Fr.
Bajo guía ecográfica se ubica el FOP y se traspasa el mismo con la punta del catéter MP (se puede utilizar también una cuerda teflonada o hidrofílica con punta recta, en este caso pudimos pasar solamente con la punta del catéter MP). Una vez en aurícula izquierda (AI), se avanza la cuerda teflonada curva hacia vena pulmonar superior izquierda (VPSI) y se avanza el catéter MP hacia la misma.
Se indica al anestesiólogo que se colocan 5000 UI de heparina sódica por vía intravenosa para mantener un ACT > 300. Se realiza el intercambio de cuerda teflonada por una cuerda Amplatz Super Stiff (Boston Scientific) a través del catéter MP 5 Fr.
Hay que poner incapié en realizar una curva en la parte floppy de la cuerda Amplatz para que no existan complicaciones a nivel de VPSI.
Una vez con la cuerda Amplatz Super Stiff en VPSI se procede a retirar el introductor femoral 5Fr e intercambiar por la vaina curva 9Fr junto al dilatador. Una vez que se cruza el defecto con la punta del dilatador y la vaina, hay que tener cuidado de que la punta del dilatador no toque la AI, por lo que una vez en AI, se mantiene punto fijo a nivel de cuerda Amplatz y dilatador, avanzándose solo la vaina.
Una vez con la vaina a nivel de AI, se alista el dispositivo en el liberador y se purga para que no existan partículas de aire.
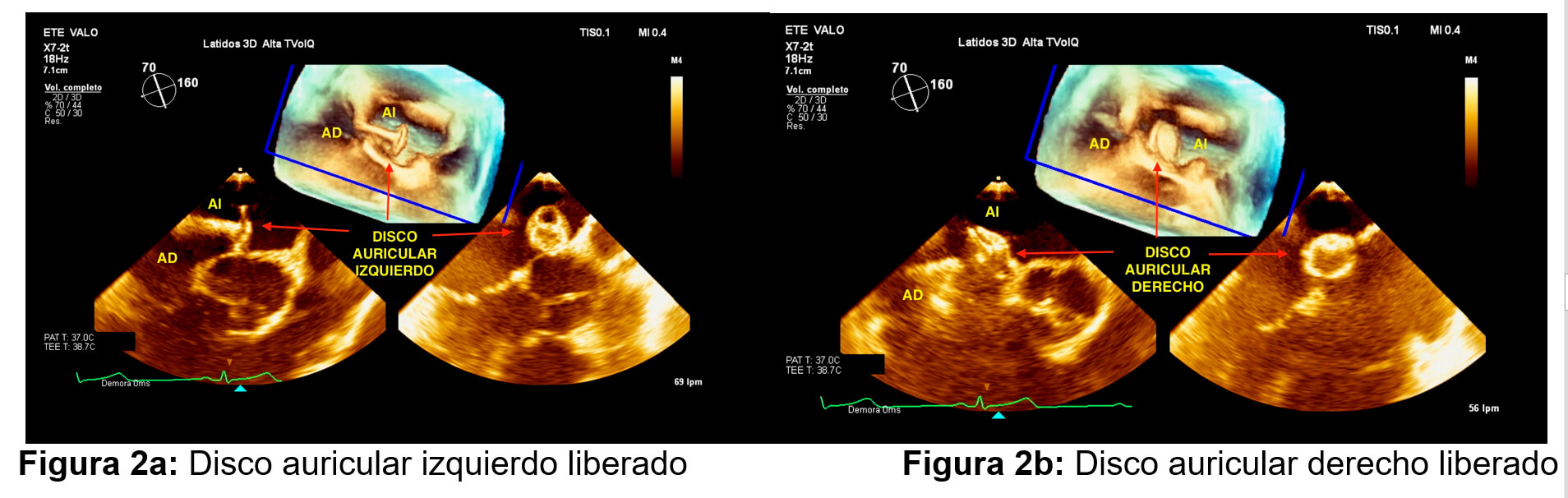
Uno de los pasos más importantes es el montaje del dispositivo a nivel de la vaina, ya que existe la posibilidad de entrada de aire por la vaina a AI, razón por la cual se realiza el montaje sumergiendo la vaina y el dispositivo dentro de un envase con suero fisiológico heparinizado, a la vez que se retira la cuerda a Amplatz. Se avanza un oclusor FIGULLA FLEX II PFO No. 23/25 mm sobre la vaina, se despliega el disco auricular izquierdo (Figura 2a) en AI el mismo que se posiciona bajo control de ETE. Se realiza maniobra de retirar el dispositivo con el liberador para que el disco izquierdo se posicione sobre el borde aórtico. Posteriormente, se libera el disco auricular derecho (Figura 2b) corroborando la adecuada colocación del oclusor con fluoroscopía y ecocardiografía transesofágica.
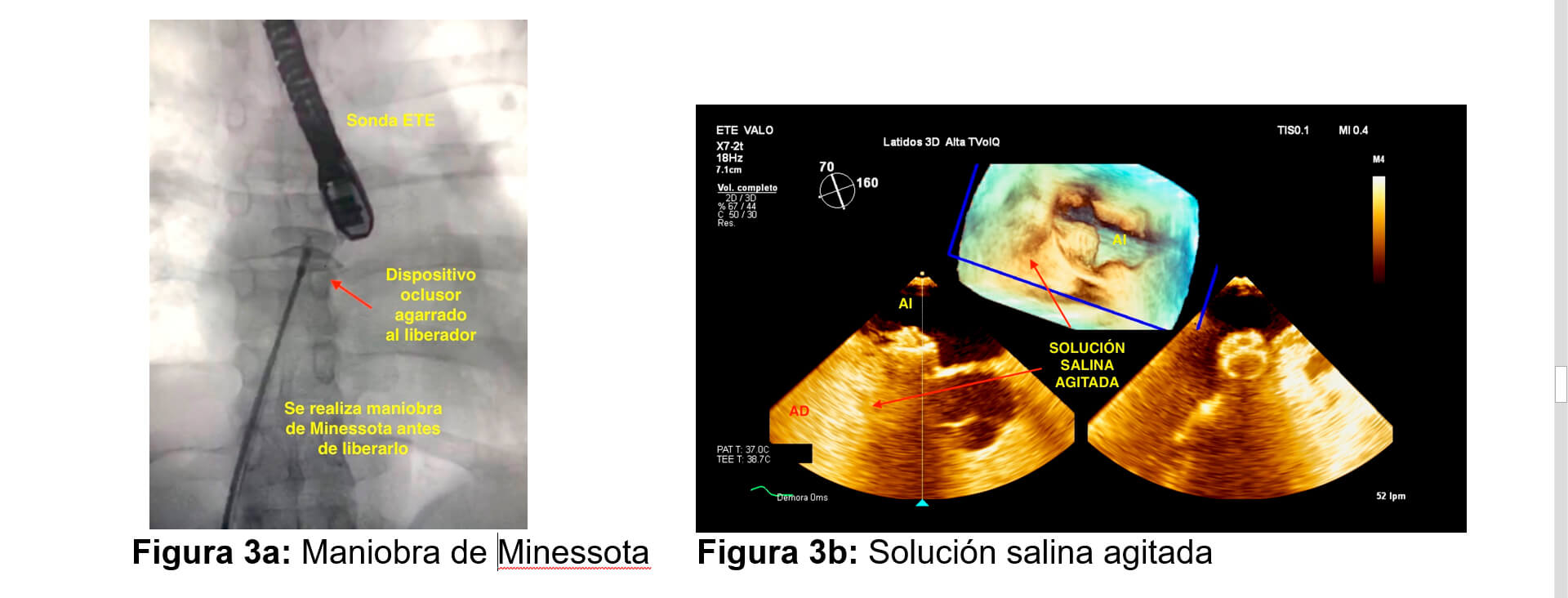
Una vez liberado los dos discos, se realiza maniobra de Minnesota (se empuja y se tira para ver que el oclusor esté bien adherido a los bordes) bajo control fluoroscópico y ecocardiográfico (Figura 3a) observando adecuado posicionamiento del oclusor. Se administra solución salina agitada (Figura 3b) observando ausencia de cortocircuito por el tabique interauricular. Se libera el oclusor con éxito. Se retira el introductor venoso y se da por terminado el procedimiento.
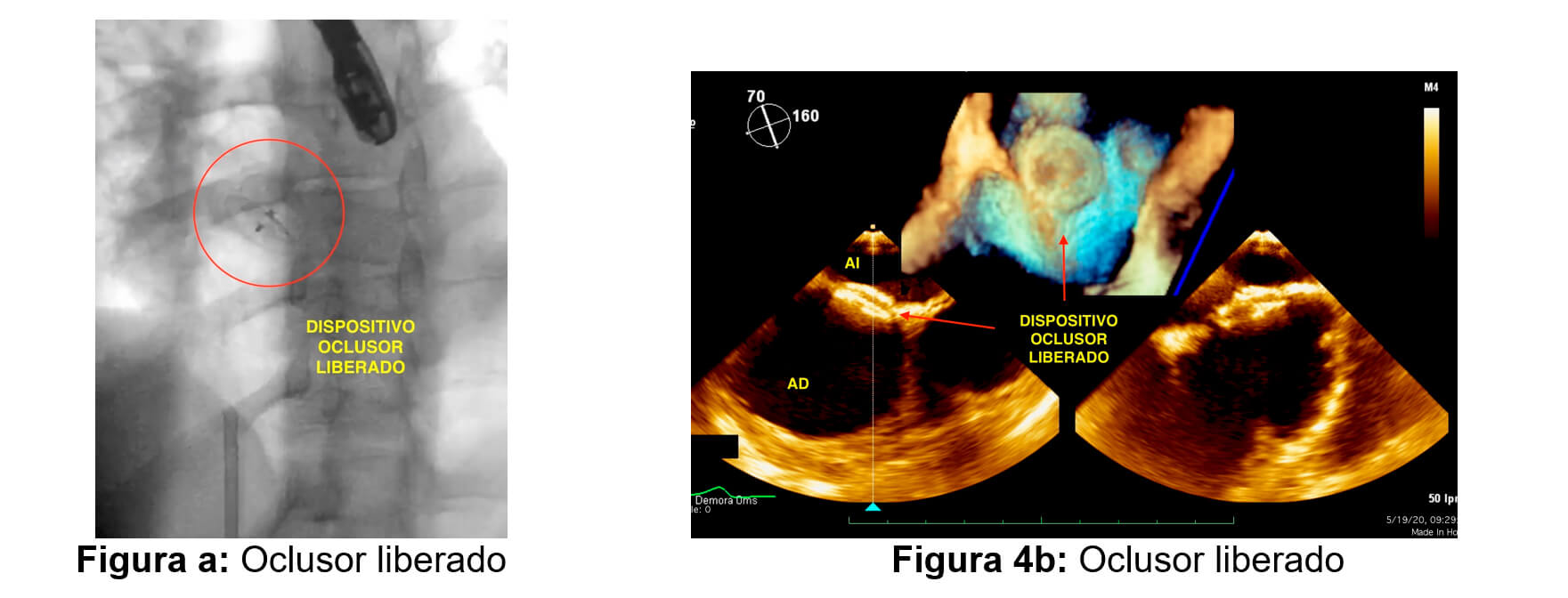
El procedimiento finaliza sin complicaciones. El paciente queda con doble antiagregación con aspirina 100mg y clopidogrel 75 mg por lo menos por 6 meses. Actualmente el paciente se encuentra asintomático.
Comentario Final:
Este es un ejemplo de cómo se debe evaluar un paciente con ACC. Debe ser evaluado por un equipo multisciplinario, de una manera global, analizando si realmente tiene una indicación para realizar el cierre percutáneo del defecto interauricular, descartando todas las otras causas probables. Al mismo tiempo, uno como hemodinamista, debe ser realista y evaluar si es capaz técnicamente de poder realizar el cierre del defecto y la factibilidad de que su cierre sea exitoso.
La indicación terapéutica de cierre percutáneo del defecto interauricular (en este caso el FOP) está basada en los beneficios que nos ofrece el mismo con respecto a una prevención primaria o secundaria basada en la clínica, anatomía y características del defecto y de su viabilidad para cierre percutáneo.
Actualmente, gracias a la combinación de la industria, el desarrollo de nuevos materiales y a la formación de equipos de hemodinamia estructural existen muy buenos resultados de éxito de cierre de los defectos del septum interauricular.
Dr. Andrés Navarro
Hospital de los Valles. Hospital De Especialidades Eugenio Espejo.
Quito, Ecuador
Bibliografía
- Hara H, Virmani R, Ladich E, et al. Patent foramen ovale: current pathology, pathophysiology, and clinical status. J Am Coll Cardiol 2005; 46:1768.
- Christian Pristipino et al. European position paper on the management of patients with patent foramen ovale. General approach and left circulation thromboembolism. EuroIntervention 2019;14:1389-1402.
- Rie Nakayama et al. Identification of High-Risk Patent Foramen Ovale Associated With Cryptogenic Stroke: Development of a Scoring System. Am Soc Echocardiogr 2019;32:811-6.
- Fareed Moses S. Collado, MD et al. Patent Foramen Ovale Closure for Stroke Prevention and Other Disorders.
- Hart RG, Diener HC, Coutts SB, et al. Embolic strokes of undetermined source: the case for a new clinical construct. Lancet Neurol 2014; 13:429.
- Rie Nakayama et al. Identification of High-Risk Patent Foramen Ovale Associated With Cryptogenic Stroke: Development of a Scoring System. Journal of the American Society of Echocardiography July 2019.




