El implante de stents en el tracto de salida del ventrículo derecho (VSVD) puede utilizarse en numerosas situaciones en las que existe la necesidad de ampliar el flujo proveniente del ventrículo derecho hacia las arterias pulmonares: neonatos con cuadros de hipoxemia (1-3), posoperatorio inmediato de ampliación de la VSVD en pacientes que se encuentran en una grave situación hemodinámica y en el posoperatorio tardío de cirugías con ampliación de la VSVD con conducto o parche transanular (4, 5) para preparar estas vías de salida para el implante percutáneo de válvulas pulmonares (6-10). Esta última será nuestro objetivo principal.
A continuación, presentamos los pasos a seguir para el implante de stents con esta finalidad:
- Anestesia general: son procedimientos prolongados, con gran manipulación de catéteres y con necesidad de cambios de introductores, lo que puede generar molestias en el paciente, que puede cambiar de posición perdiendo así los parámetros obtenidos para posicionar el stent;
- Múltiples angiografías: es necesario realizarlas para contar con medidas precisas de los diámetros y longitudes del tracto de salida. Las proyecciones OAD craneal y de perfil izquierdo generalmente son las ideales. Para la inyección en el perfil izquierdo es necesario colocar los brazos hacia arriba, lo que permite tener una visualización adecuada;
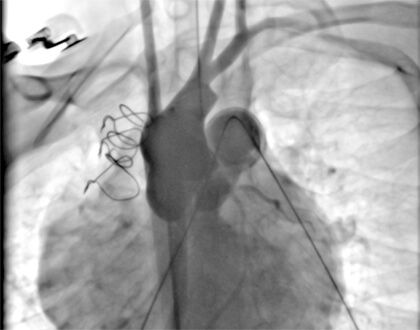
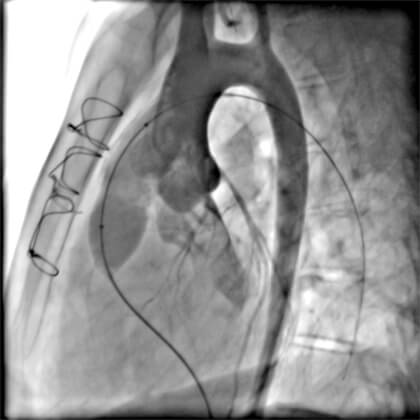
- Angiografía aórtica y prueba de compresión coronaria: en todos los pacientes candidatos al implante de stent en la VSVD debe realizarse la prueba de compresión coronaria con insuflación del balón con el diámetro deseado y angiografía aórtica concomitante. Pueden realizarse diversas proyecciones para evaluar la proximidad de la arteria coronaria. Las proyecciones caudal (OAD ó AP) y de perfil izquierdo generalmente muestran si existe riesgo de compresión con el implante definitivo del stent (Figuras 1 y 2);
Figura 1
Prueba de compresión coronaria en proyección perfil izquierdo: balón insuflado en la VSVD y angiografía aórtica concomitante mostrando flujo coronario adecuado.
Figura 2
Prueba de compresión coronaria en proyección OAE caudal: balón insuflado en la VSVD y angiografía aórtica concomitante mostrando la proximidad de la arteria descendente anterior pero con el flujo adecuado.
- Posicionamiento del stent para el implante: se debe elegir una proyección ideal para el implante, dependiendo de la anatomía y de la preferencia del operador. En general, la proyección del perfil izquierdo permite visualizar toda la vía de salida y la OAD craneal ayuda a posicionar el stent debajo de la bifurcación de las arterias pulmonares;
- Posicionamiento de la guía para el implante: éste es uno de los pasos más importantes para el éxito del procedimiento. Siempre utilizamos guías 0,035" extra stiff posicionadas en la región más distal e inferior de la arteria pulmonar elegida. La mayor parte de las veces se elige la arteria pulmonar izquierda, pero en algunas variaciones anatómicas nativas o después de manipulación quirúrgica la arteria pulmonar derecha puede ser la mejor opción. Con la ayuda del catéter Judkins derecho, Multipropósito o Wedge® y una guía hidrofilica 0,035", la arteria es cateterizada y después de obtener el lugar ideal, ésta se intercambia por la guía extra stiff elegida. Se debe tener un cuidado adicional para no perder el posicionamiento y para evitar el trauma vascular asociado;
- Posicionamiento de la vaina de Mullins: la vaina compatible con el conjunto balón-stent debe avanzar yendo más allá del lugar del implante. Su posicionamiento permite que el operador prevea cómo será el avance del stent. La vaina debe utilizarse principalmente en anatomías más complejas, con múltiples curvas en la VSVD y en las arterias pulmonares;
- Elección del balón y del stent: el stent a implantar debe tener unas dimensiones como para cubrir totalmente el tracto de salida o conducto con un diámetro suficiente como para evitar la migración. La VSVD de los pacientes sometidos a parche transanular generalmente está dilatada, puede alcanzar diámetros superiores a 25 mm. Hay pocas opciones de stents disponibles en América Latina que permitan una dilatación hasta esa medida, lo que torna inviable este procedimiento en esas situaciones. Para pacientes portadores de conducto VD-TP lo ideal es conocer previamente el diámetro, pues muchas veces hay una intensa calcificación del tubo y sus dimensiones son más pequeñas que las reales. Para esos casos, se debe realizar la dilatación previa con catéter-balón en el sentido de "probar" la complacencia con diámetros progresivamente superiores. Debido al riesgo de fractura de la VSVD lo ideal siempre es tener un stent cubierto como backup ante una eventual situación de emergencia. Se deben realizar nuevas angiografías luego de cada insuflación del balón, evitando ampliar eventuales líneas de disección;
- Posicionamiento e implante del stent: el conjunto balón-stent avanza sobre la guía y se lo posiciona en la VSVD de acuerdo a la angiografía previa. Siempre se debe observar si el stent está bien posicionado sobre el balón antes de retirar la vaina. A través de la vaina se pueden realizar angiografías de ajuste antes de exponer totalmente el stent y también después de implantarlo. El manómetro debe utilizarse para la insuflación respetando los límites de presión de cada balón;
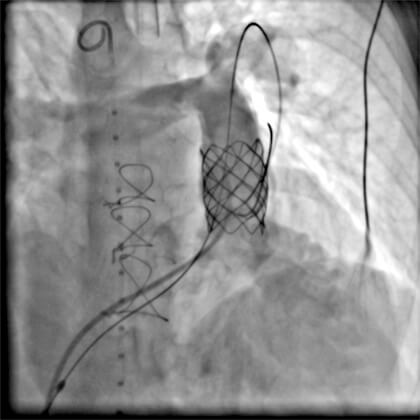
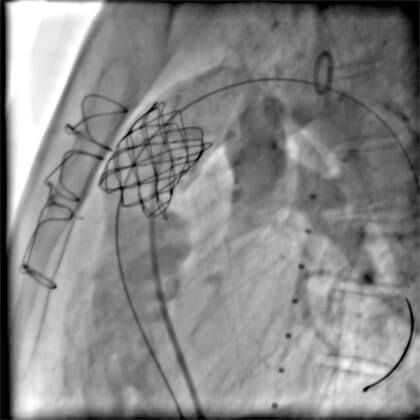
- Angiografías finales: después del implante se realizan nuevas angiografías con el uso de diversos catéteres, como el Multitrack® o pigtail (Figuras 3 y 4). La desventaja de este último es la necesidad de retirar la guía de la arteria pulmonar;
Figura 3
Angiografía posterior al implante en perfil izquierdo: stent bien posicionado en la VSVD, cubriendo toda su extensión.
Figura 4
Angiografía posterior al implante en proyección OAE craneal: stent bien posicionado en la VSVD, con buen flujo hacia las arterias pulmonares.
- Retiro de la guía extra stiff: Este es un paso importante, se debe realizar con cuidado, haciendo avanzar el catéter por la guía y remplazándola por la hidrófila, evitando el desplazamiento del stent recién implantado;
- Retiro del introductor y hemostasia: debido a las dimensiones del introductor utilizado es posible posicionar dispositivos de sutura del vaso (Perclose®, por ejemplo). La sutura en "8" o la compresión hemostática también son efectivas para lograr la hemostasia adecuada.
Referencias:
- Dohlen G, Chaturvedi RR, Benson LN, Ozawa A, Van Arsdell GS, Fruitman DS, et al. Stenting of the right ventricular outflow tract in the symptomatic infant with tetralogy of Fallot. Heart. 2009;95(2):142-7.
- Bertram H, Emmel M, Ewert P, Grohmann J, Haas NA, Jux C, et al. Stenting of Native Right Ventricular Outflow Tract Obstructions in Symptomatic Infants. Journal of interventional cardiology. 2015;28(3):279-87.
- Barron DJ, Ramchandani B, Murala J, Stumper O, De Giovanni JV, Jones TJ, et al. Surgery following primary right ventricular outflow tract stenting for Fallot's tetralogy and variants: rehabilitation of small pulmonary arteries. European journal of cardio-thoracic surgery. 2013;44(4):656-62.
- Boudjemline Y, Sarquella-Brugada G, Kamache I, Patel M, Ladouceur M, Bonnet D, et al. Impact of right ventricular outflow tract size and substrate on outcomes of percutaneous pulmonary valve implantation. Archives of cardiovascular diseases. 2013;106(1):19-26.
- Malekzadeh-Milani S, Ladouceur M, Cohen S, Iserin L, Boudjemline Y. Results of transcatheter pulmonary valvulation in native or patched right ventricular outflow tracts. Archives of cardiovascular diseases. 2014;107(11):592-8.
- Nordmeyer J, Lurz P, Khambadkone S, Schievano S, Jones A, McElhinney DB, et al. Pre-stenting with a bare metal stent before percutaneous pulmonary valve implantation: acute and 1-year outcomes. Heart. 2011;97(2):118-23.
- Demkow M, Biernacka EK, Spiewak M, Kowalski M, Siudalska H, Wolski P, et al. Percutaneous pulmonary valve implantation preceded by routine prestenting with a bare metal stent. Catheterization and cardiovascular interventions. 2011;77(3):381-9.
- Cardoso R, Ansari M, Garcia D, Sandhu S, Brinster D, Piazza N. Prestenting for prevention of melody valve stent fractures: A systematic review and meta-analysis. Catheterization and cardiovascular interventions. 2016;87(3):534-9.
- McElhinney DB, Cheatham JP, Jones TK, Lock JE, Vincent JA, Zahn EM, et al. Stent fracture, valve dysfunction, and right ventricular outflow tract reintervention after transcatheter pulmonary valve implantation: patient-related and procedural risk factors in the US Melody Valve Trial. Circulation Cardiovascular interventions. 2011;4(6):602-14.
- Bishnoi RN, Jones TK, Kreutzer J, Ringel RE. NuMED Covered Cheatham-Platinum Stent for the treatment or prevention of right ventricular outflow tract conduit disruption during transcatheter pulmonary valve replacement. Catheterization and cardiovascular interventions. 2015;85(3):421-7.