Degeneración de prótesis valvular percutánea y durabilidad
El implante percutáneo de válvula aórtica conocido como TAVI (Transcatheter Aortic Valve Implantation), ha revolucionado el tratamiento de la estenosis aórtica (EA). Aunque es una opción terapéutica relativamente nueva con respecto al reemplazo valvular quirúrgico (RVAQ), en los últimos 15 años, su uso se ha extendido desde ser una alternativa eficaz y segura para el tratamiento de pacientes con EA severa cuando por su alto riesgo son inoperables o este riego quirúrgico es elevado (indicación I-A según guías clínicas americanas o I-B según guías europeas). Más aun, estudios recientes sentaron indicación para el tratamiento de pacientes con riesgo intermedio (STS 4-8%), plasmado este año con indicación IIa-B en las guías clínicas americanas y I-B en las europeas.1
Dado el rápido desarrollo tecnológico, el envejecimiento de la población y la ampliación de su indicación a pacientes con menor riesgo, se espera incrementos no solo en el número absoluto de implantes sino también en la proporción de pacientes de menor riesgo, y, por lo tanto, más jóvenes. En este contexto, dada la mayor expectativa de vida, la durabilidad del implante valvular a largo plazo es un punto crítico en la decisión terapéutica, entre un tratamiento de reemplazo con cirugía tradicional o TAVI.2
La experiencia quirúrgica ha evidenciado que las prótesis biológicas tienen como punto débil su durabilidad limitada en el tiempo, siendo la degeneración la principal causa de fallo valvular. Tal es así que porcentaje de pacientes sin necesidad de re-intervención es 94% a los 10 años, pero cae a 53% a los 20 años.3, 4 A pesar del número creciente de publicaciones todavía hay pocos datos sobre la durabilidad de las prótesis percutáneas más allá de los 5 años. Además, existen inconsistencias en su definición y por lo tanto grandes diferencias en las incidencias reportadas. En la tabla 1 se listan las principales publicaciones con datos sobre la durabilidad de las TAVI.
La definición de “deterioro” (o “degeneración”) valvular estructural (DVE) del consorcio de investigación académica (Valve Academic Reseach Consortium, VARC-2)5 es la utilizada más frecuentemente en la actualidad:
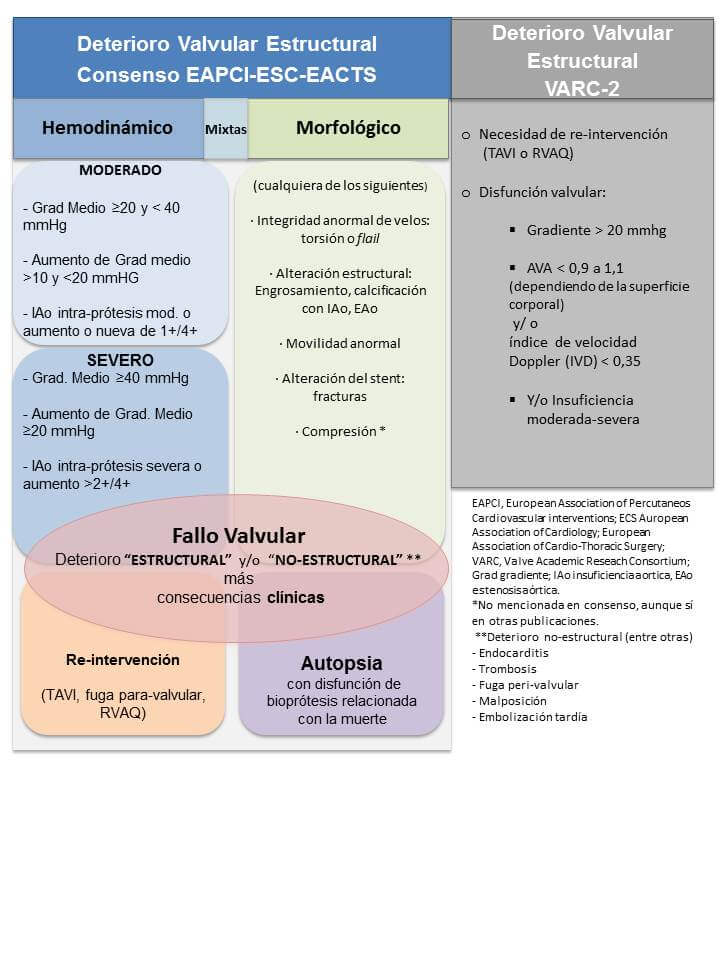
En una publicación reciente, las sociedades científicas europeas han propuesto definiciones más precisas de este fenómeno amplio de “fallo valvular” para TAVI y RVAQ. Se describen dos formas de deterioro valvular: “no-estructural”, que incluye procesos extrínsecos (endocarditis y trombosis entre otros) y el “deterioro estructural” que se refiere a cambios intrínsecos adquiridos en la estructura de la prótesis. El deterioro estructural tiene, a su vez, dos tipos predominantes (aunque no excluyentes): “morfológico” y “hemodinámico”, este último basado en cambios permanentes detectados por ecocardiografía. Finalmente el consenso define al “fallo de la bio-prótesis” como un concepto integrador entre el deterioro de la prótesis y su consecuencia clínica (síntomas, re-intervención, muerte) y se propone como objetivo para unificar el reporte de la incidencia de eventos.6
En el caso de las prótesis quirúrgicas, la degeneración con calcificación de los velos es la causa más frecuente de fallo y podría también ser el caso en las percutáneas. Sin embargo, existen diferencias en el diseño y técnica que pueden causar disminución de la durabilidad en el caso de estas últimas. En el implante percutáneo, la persistencia de la válvula nativa es un factor clave ya que se asocia la calcificación con expansión incorrecta de la prótesis lo cual puede condicionar presencia de asimetría y leaks, los que a su vez generarían flujos turbulentos y degeneración acelerada. Por otro lado, los velos nativos desplazados por la prótesis pueden alterar los flujos en los senos de Valsalva provocando zonas de mayor estancamiento lo cual predispone a trombosis.7 8 De hecho, en un estudio de estrés mecánico, la anatomía ovalada del tracto de salida y anillo podría alterar el flujo y favorecer daño estructural, lo cual se agrava en casos de infra-expansión por oversizing.2
Las prótesis percutáneas más frecuentemente utilizadas se construyen con tejido pericárdico, ya sea de origen bovino en el caso de Edwards-SAPIEN (Edwards Lifesciences) y porcino en el caso de CoreValve (Medtronic, Inc.). El tipo de material biológico podría influir la durabilidad a largo plazo y es materia de estudio actualmente.9 Otra diferencia con respecto a las prótesis quirúrgicas es que los velos son más finos (0.25 vs 0.4 mm aproximadamente) y requiere el prensado en el sistema de liberación. Estos dos factores podrían condicionar una menor resistencia al estrés hemodinámico.2
Las series observacionales quirúrgicas han mostrado que la edad al momento de implante es uno de los factores de más peso en la incidencia de degeneración bio-protésica, y este concepto podría extrapolarse a las prótesis percutáneas.10 Esto se debe, por un lado, a una expectativa de vida mayor que daría tiempo al proceso progresivo de deterioro, y por otro a factores de tipo inmunológico y/o hemodinámicos. Existen otros factores predisponentes de degeneración como alteraciones del metabolismo fosfo-cálcico, insuficiencia renal y factores de riesgo cardiovasculares clásicos.4, 3 Otros potenciales predictores de degeneración temprana podría ser la ausencia de anticoagulación, prótesis pequeñas (23-mm), procedimientos Valve-in-Valve y obesidad.11 En un análisis a 5 años con válvula balón-expandible el área valvular pequeña al alta también fue un predictor independiente de DVE.12 Se desconoce, por el momento, si el tipo de prótesis percutánea tendría influencia en la durabilidad a largo plazo.
La formación de trombo en las prótesis aórticas percutáneas es un fenómeno heterogéneo que puede cursar de forma sintomática (2.8%) o, más frecuentemente, asintomática con prevalencia de hasta 12%.13,14 Se ha observado inicialmente en prótesis quirúrgicas aunque su incidencia sería mayor en las prótesis percutáneas (4 vs 13%).15 La falta de tratamiento anticoagulante se ha relacionado en varios estudios a degeneración valvular aunque por fallos metodológicos no se puede establecer una relación causal clara.11, 16 La trombosis podría disminuir la movilidad de los velos lo cual llevaría a sobreestimación de las incidencias de DVE. Por otro lado, la propia trombosis y consecuente alteración en el flujo pueden causar aceleración del proceso de degeneración de los velos.
La incidencia de DVE de prótesis percutáneas en seguimientos de hasta los 5 años es en general muy baja. Un meta-análisis reciente que incluyo 8914 pacientes (entre 2004 y 2015) reportó una incidencia total estimada de 28 por 10.000 pacientes/año que equivale a una incidencia de 0.6% a los 2 años.17
Estas cifras elevadas en seguimientos más largos se deben probablemente a que se usaron prótesis de primera generación, fueron pacientes más añosos con calcificación marcada y factores tecnológicos menos desarrollados. Sin embargo, existe la posibilidad que la válvula presente degeneración a tasas más elevadas pasados los 10 años de seguimiento, como ocurre con sus homólogas quirúrgicas.
El DVE puede ser asintomático, o presentarse como insuficiencia/estenosis de diferentes grados. Si se documenta aumento de gradientes se debe valorar la presencia de trombosis, iniciando tratamiento anticoagulante en ese caso. Una vez descartada esta última, y si se confirma el DVE, a día de hoy se considera como primera línea el tratamiento percutáneo.18 Datos preliminares muestran que procedimientos Valve-in-Valve han mostrado ser una opción viable y con menor riesgo de complicaciones post-operatorias que una nueva cirugía a corto y mediano plazo. En el caso de pacientes con TAVI previa dado el riesgo, de inicio elevado, la toracotomía no es a priori una opción en comparación a un procedimiento que técnicamente no es de excesiva complejidad.19 Algunos autores afirman que la presencia de una válvula previa podría facilitar la elección la nueva prótesis y el implante. La desventaja de esta técnica es, nuevamente, la escasez datos, y la durabilidad de la segunda prótesis teniendo en cuenta que en algunos estudios el Valve-in-Valve se asoció a degeneración protésica.11 20 21 Otro punto a tener en cuenta, es que el acceso a los ostium coronarios podría verse dificultado en casos de prótesis de se extienden hacia la raíz de aorta.18
En conclusión, los datos actuales permiten afirmar que la durabilidad reportada de la TAVI es adecuada para la población de mayor edad o de alto o moderado riesgo quirúrgico. Sin embargo, todavía se requiere mas evidencia, con estudio detallado de estructura y función, así como seguimiento a más largo plazo (>10 años) para confirmar que la durabilidad de la prótesis es mayor que la expectativa de vida esperada del paciente. Una vez que se disponga de datos que confirmen una funcionalidad adecuada a largo plazo, es probable que la TAVI se extienda a pacientes jóvenes y se establezca como una opción real frente a la cirugía cardíaca en este grupo de pacientes de menor riesgo.
Tabla 1: Estudios reportando durabilidad valvular a largo lazo
|
Autor/ año |
Tipo publicación/ estudio |
Número pacientes TAVI1 |
Seguimiento (media o mediana) (años) |
Tipo Válvula2 |
Incidencia DVE |
Definición de DVE |
Tipo DVE / Comentarios |
|
Ussia22 2012 |
Cohorte, multicéntico (registro Italiano) |
181 |
3 |
AE |
0% |
Criterios VARC |
· Grad. estables
|
|
Mack23 2015 |
PARTNER 1 (seguimiento a 5 años) |
384 |
5 |
BE |
0% |
Re-intervención
|
· Grad. y áreas estables |
|
Deeb24 2016 |
Aleatorizado, multicéntrico (Corevalve U.S. Pivotal Trial) |
228 |
3 |
AE |
- 0%
- 9,5%
|
Estructurales
Aumento Grad >50% |
· Grad y áreas estables |
|
Foroutan17 2017 |
Meta-análisis (13 estudios) |
8.914 |
1,8 a 5 |
BE 56% AE 35% NR 9%
|
0 a 5,5% |
Criterios VARC y Grad >20mmHg |
· Incidencia agrupada de 28/10.000 pac-año |
|
Gerckens25 2017 |
Cohorte prospectiva, multicéntrica |
860 |
3 |
AE |
- 0,9%
- 2,6 % (n=22)
- 9,3%
|
- Reporte inicial
- VARC-2 (post-hoc)
- Aumento Grad >50% (Post-hoc) |
· n 22 (10 EAo, 11 IAo mod-severa, 1 mixto) · Re-int. 1,2% (n=10 (4 Qx y 6 TAVI) |
|
Douglas26 2017 |
PARTNER 1A y 1B
|
424 (con ETT a 5 años) |
3,1
|
BE |
- 0,5%
- 3,5-49%
|
- Grad Med absoluto >40 mmHg
- VARC-2 de EAo leve |
· Re-int. 0,8% (n=20, mayoría leak, 3 IAo, 4 EAo y 1 DVE) |
|
Muratori12 2017 |
Cohorte, unicéntrica |
96 |
4,9 (con ETT) 5,4 (clínico) |
BE |
30% |
Engrosamiento (>3mm), calcificación y movimiento anormal de velos |
· No Re-int · Aumento leve-mod. de Grad · IAo en 45% de DVS |
DVE, deterioro valvular estructural; BE balón-expandible, AE, auto-expandible; VARC, Valve Academic Research Conseortium; EAo, estenosis aortica; IAo, insuficiencia aortica; Grad, gradientes; Seg, seguimiento; Valv, válvulas; NR no reportado; Pac, pacientes; Re-int, re-intervención (quirúrgica o percutánea); ETT ecocardiograma transtorácico; Mod, moderado; KM Kaplan-Meier.
1: Pacientes disponibles para análisis ecocardiográfico/clínico al seguimiento indicado, excepto en el meta-análisis.
2: BE, balón-expandible; incluye -según estudios- Cribier-Edwards TM, Edwards SAPIEN, Edwards SAPIEN-XT). AE, auto-expandible, mayoría Medtronic CoreValve.
E-mail: luverapernasetti@yahoo.com.ar
E-mail: rodrigobagur@yahoo.com
Referencias
- Barbanti, M., Webb, J. G., Gilard, M. & Capodanno, D. Transcatheter aortic valve implantation in 2017: state of the art. 11–21 (2017).
- Bagur, R., Pibarot, P. & Otto, C. M. Importance of the valve durability-life expectancy ratio in selection of a prosthetic aortic valve. Heart 103, 1756–1759 (2017).
- Arsalan, M. & Walther, T. Durability of prostheses for transcatheter aortic valve implantation. Nat. Rev. Cardiol. 13, 360–367 (2016).
- Côté, N., Pibarot, P. & Clavel, M.-A. Incidence, risk factors, clinical impact, and management of bioprosthesis structural valve degeneration. Curr. Opin. Cardiol. 1 (2017). doi:10.1097/HCO.0000000000000372
- Kappetein, A. P. et al. Updated standardized endpoint de fi nitions for transcatheter aortic valve implantation : the Valve Academic Research Consortium-2 consensus document. Eur. Heart J. 33, 2403–2418 (2012).
- Capodanno, D. et al. Standardized definitions of structural deterioration and valve failure in assessing long-term durability of transcatheter and surgical aortic bioprosthetic valves: a consensus statement from the European Association of Percutaneous Cardiovascular Interven. Eur. J. Cardio-Thoracic Surg. 1–10 (2017). doi:10.1093/ejcts/ezx244
- Ducci, A., Pirisi, F., Tzamtzis, S. & Burriesci, G. Transcatheter aortic valves produce unphysiological flows which may contribute to thromboembolic events: An in-vitro study. J. Biomech. 49, 4080–4089 (2016).
- Midha et al. The Fluid Mechanics of Transcatheter Heart Valve Leaflet Thrombosis in the Neo-Sinus. Circulation 136,1598-1609. (2017).
- Caballero, A., Sulejmani, F., Martin, C., Pham, T. & Sun, W. Evaluation of transcatheter heart valve biomaterials: Biomechanical characterization of bovine and porcine pericardium. J. Mech. Behav. Biomed. Mater. 75, 486–494 (2017).
- Wang, M., Furnary, A. P., Li, H. F. & Grunkemeier, G. L. Bioprosthetic Aortic Valve Durability: A Meta-Regression of Published Studies. Ann. Thorac. Surg. 104, 1080–1087 (2017).
- Del Trigo, M. et al. Incidence, timing, and predictors of valve hemodynamic deterioration after transcatheter aortic valve replacement multicenter registry. J. Am. Coll. Cardiol. 67, 644–655 (2016).
- Muratori, M. et al. Five-year echocardiographic follow-up after TAVI: structural and functional changes of a balloon-expandable prosthetic aortic valve. Eur. Hear. J. - Cardiovasc. Imaging 1–9 (2017). doi:10.1093/ehjci/jex046
- Puri, R., Auffret, V. & Rodés-Cabau, J. Bioprosthetic Valve Thrombosis. J. Am. Coll. Cardiol. 69, 2193–2211 (2017).
- Jose, J. et al. Clinical Bioprosthetic Heart Valve Thrombosis After Transcatheter Aortic Valve Replacement: Incidence, Characteristics, and Treatment Outcomes. JACC Cardiovasc. Interv. 10, 686–697 (2017).
- Chakravarty, T. et al. Subclinical leaflet thrombosis in surgical and transcatheter bioprosthetic aortic valves: an observational study. Lancet 389, 2383–2392 (2017).
- Sondergaard, L. et al. Natural history of subclinical leaflet thrombosis affecting motion in bioprosthetic aortic valves. Eur. Heart J. 1–7 (2017). doi:10.1093/eurheartj/ehx369
- Foroutan, F. et al. Structural valve deterioration after transcatheter aortic valve implantation. Heart 103, 1899–1905 (2017).
- Barbanti, M. & Tamburino, C. Late degeneration of transcatheter aortic valves: Pathogenesis and management. EuroIntervention 12, Y33–Y36 (2016).
- Spaziano, M. et al. Transcatheter Aortic Valve Implantation Versus Re-do Surgery for Failing Surgical Aortic Bioprosthesis: a Multi-Centre Propensity Score Analysis. EuroIntervention 1149–1156 (2017). doi:10.4244/EIJ-D-16-00303
- Durko, A. P., Osnabrugge, R. L. & Kappetein, A. P. Long-term outlook for transcatheter aortic valve replacement. Trends Cardiovasc. Med. 1–10 (2017). doi:10.1016/j.tcm.2017.08.004
- Martin, C. & Sun, W. Transcatheter Valve Underexpansion Limits Leaflet Durability: Implications for Valve-in-Valve Procedures. Ann. Biomed. Eng. 45, 394–404 (2017).
- Ussia, G. P. et al. Transcatheter aortic valve implantation: 3-year outcomes of self-expanding CoreValve prosthesis. Eur. Heart J. 33, 969–976 (2012).
- Mack, M. J. et al. 5-year outcomes of transcatheter aortic valve replacement or surgical aortic valve replacement for high surgical risk patients with aortic stenosis (PARTNER 1): A randomised controlled trial. Lancet 385, 2477–2484 (2015).
- Deeb, G. M. et al. 3-Year Outcomes in High-Risk Patients Who Underwent Surgical or Transcatheter Aortic Valve Replacement. J. Am. Coll. Cardiol. 67, 2565–2574 (2016).
- Gerckens, U. et al. Final 5-year clinical and echocardiographic results for treatment of severe aortic stenosis with a self-expanding bioprosthesis from the ADVANCE Study. Eur. Heart J. 38, 2729–2738 (2017).
- Douglas, P. S. et al. Longitudinal Hemodynamics of Transcatheter and Surgical Aortic Valves in the PARTNER Trial. JAMA Cardiol. 2, 1197 (2017).




