Mecanismos de degeneración valvular transcatéter
A. Definiciones y diagnóstico de la degeneración estructural de la válvula
B. Causas y mecanismos de la degeneración de la bioprótesis
Degeneración valvular
Endocarditis
Trombosis de la bioprótesis
Leak paravalvular PPM.
Definiciones y diagnóstico de la degeneración estructural de la válvula
En la literatura, la degeneración estructural valvular (structural valve deterioration – SVD) ha sido tradicionalmente definida por la necesidad de una reintervención o por muerte relacionado con la prótesis valvular. 1,2. Sin embargo, esta definición tiende a subestimar la verdadera incidencia de la SVD, ya que una proporción considerable de pacientes que presentan esta condición no son sometidos a una nueva intervención debido al elevado riesgo quirúrgico o a una situación de fragilidad clínica significativa. 2
En este contexto, varios consensos de expertos, como los de la European Association of Cardiovascular Imaging y la European Association for Cardio-Thoracic Surgery (EAPCI/EACTS)3, el registro Valve-in-Valve International Database (VIVID) liderado por Dvir et al.1, así como el Valve Academic Research Consortium 3 (VARC-3)4 han propuesto distintas definiciones para la degeneración estructural valvular (SVD).
Según las recomendaciones más recientes, la disfunción de bioprótesis quirúrgicas y transcatéter (disfunción valvular bioprotésica – BVD) proponen cuatro mecanismos de deterioro valvular y son:
- Deterioro valvular estructural (Structural Valve Deterioration [SVD]), que involucra cambios permanentes en la válvula como fibrosis, calcificación y ruptura valvular), que conduce a una estenosis y/o insuficiencia aórtica.
- Deterioro valvular no estructural (Non-structural valve deterioration [NSVD]), que involucra anormalidades no intrínsecas a la válvula como por ejemplo leak paravalvular, mismatch prótesis-paciente, mala posición o embolización, la cual suele ocurrir durante el procedimiento de reemplazo valvular aórtico.
- Trombosis de válvula protésica
- Endocarditis infecciosa, que no se consideran ni estructurales ni no estructurales debido a su carácter potencialmente reversible mediante tratamiento anticoagulante o antibiótico, respectivamente.
Según el consenso VARC-3, la severidad de la disfunción de una bioprótesis puede clasificarse en tres estadios (Figura 1):
- Estadio 1: La degeneración morfológica de la válvula se define como la aparición de alteraciones en la morfología o movilidad de las valvas protésicas durante el seguimiento, sin deterioro hemodinámico asociado.
- Estadio 2: La degeneración hemodinámica moderada incluye los criterios del estadio 1, junto con un aumento moderado del gradiente medio (GM) al ecocardiograma de seguimiento en comparación con el ecocardiograma de referencia postprocedimiento (≥10 mmHg, resultando en un GM ≥20 mmHg), acompañado de una disminución concomitante del área efectiva del orificio valvular (EOA) (≥0,3 cm²) y/o del índice de velocidad Doppler (DVI) (≥0,1), y/o la aparición o el empeoramiento de una insuficiencia aórtica intraprotésica que resulte en una insuficiencia de grado al menos moderado.
- Estadio 3: La degeneración hemodinámica severa se define mediante los mismos parámetros que el estadio 2, pero con criterios más avanzados: un aumento del GM ≥20 mmHg (resultando en un GM ≥30 mmHg), una reducción concomitante del EOA ≥0,6 cm² y/o del DVI ≥0,2, y/o la aparición o el empeoramiento de una insuficiencia aórtica intraprotésica en al menos dos grados, resultando en una insuficiencia de grado moderado o mayor.
Figura 1. Categoría, etiología y definición de la disfunción y falla de la válvula bioprotésica. Reproducido y autorizado de Pibarot et al. 2,5 IMC: índice de masa corporal; BVD: disfunción valvular bioprotésica; BVF: falla valvular bioprotésica; EOA: área efectiva del orificio; HVD: deterioro hemodinámico valvular.
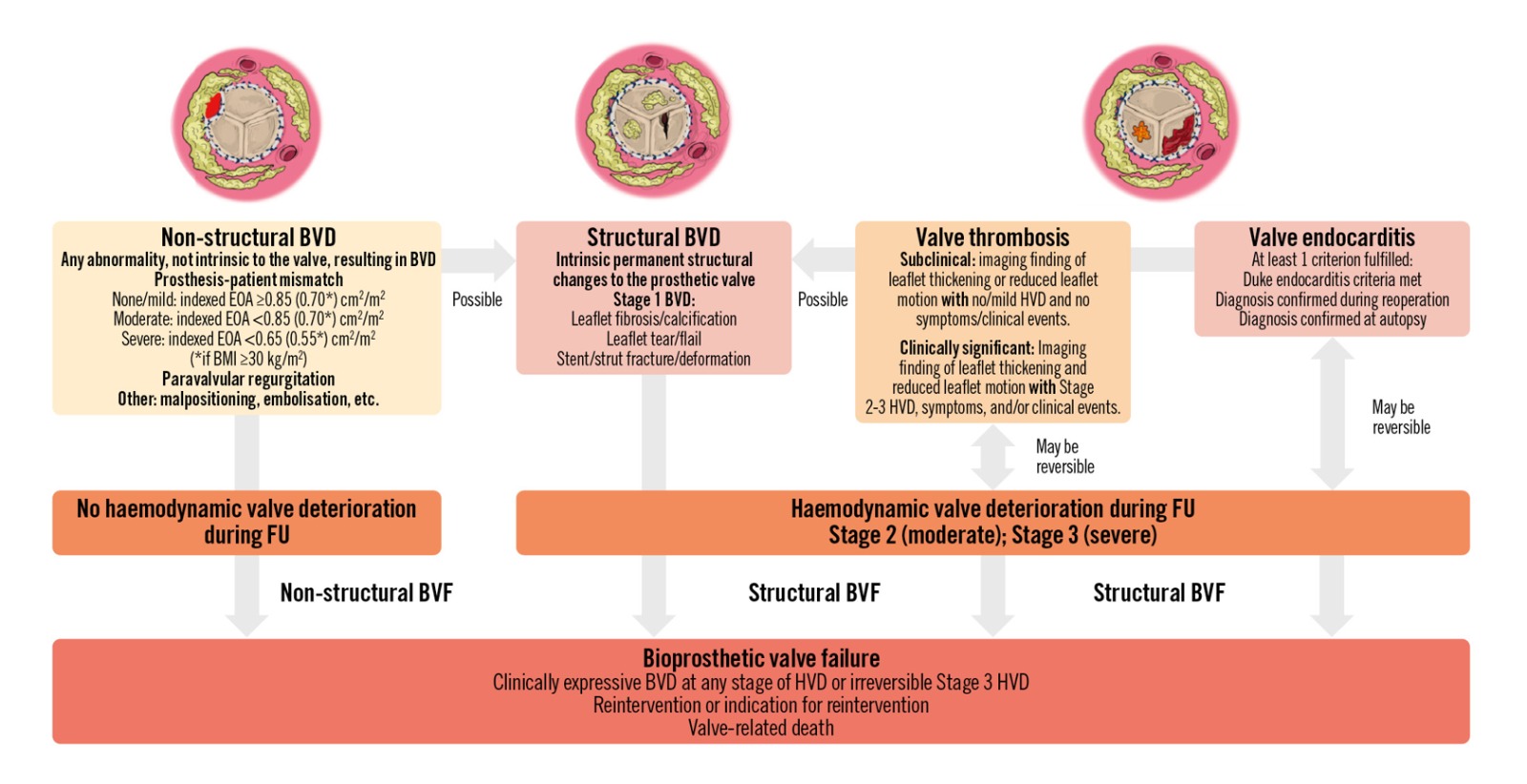
Es importante destacar que la definición de SVD difiere entre los criterios del VARC-3 y los del consenso EAPCI/EACTS. Este último considera la presencia de SVD si el GM es elevado en el ecocardiograma post-procedimiento o si presenta un aumento durante el seguimiento clínico, sin requerir una disminución concomitante EAO ni del DVI 3,4. Esta definición tiende a sobreestimar la incidencia real de SVD, ya que el mismatch prótesis-paciente (PPM) también puede generar un aumento del GD, y debería ser clasificado como una NSVD.
Por otra parte, la falla valvular bioprotésica (BVF) constituye un indicador clínico esencial de la durabilidad de las bioprótesis. La BVF se define por un conjunto de criterios (síntomas, insuficiencia cardíaca, reintervención o fallecimiento) que no necesariamente ocurren en orden cronológico y que pueden derivar de cualquier forma de BVD, ya sea de forma aislada o combinada.
Los criterios son los siguientes:
- Criterio 1: Presencia de BVD con manifestaciones clínicas (aparición o empeoramiento de los síntomas, dilatación/hipertrofia/disfunción del ventrículo izquierdo o hipertensión pulmonar), o BVD estadio 3 irreversible con alteraciones confirmadas en las valvas o en el stent mediante imágenes, y/o evaluación invasiva que confirme la disfunción.
- Criterio 2: Reintervención valvular aórtica o indicación formal de reintervención.
- Criterio 3: Muerte relacionada con la prótesis valvular
Mecanismos y factores de riesgo de la degeneración estructural de la bioprótesis
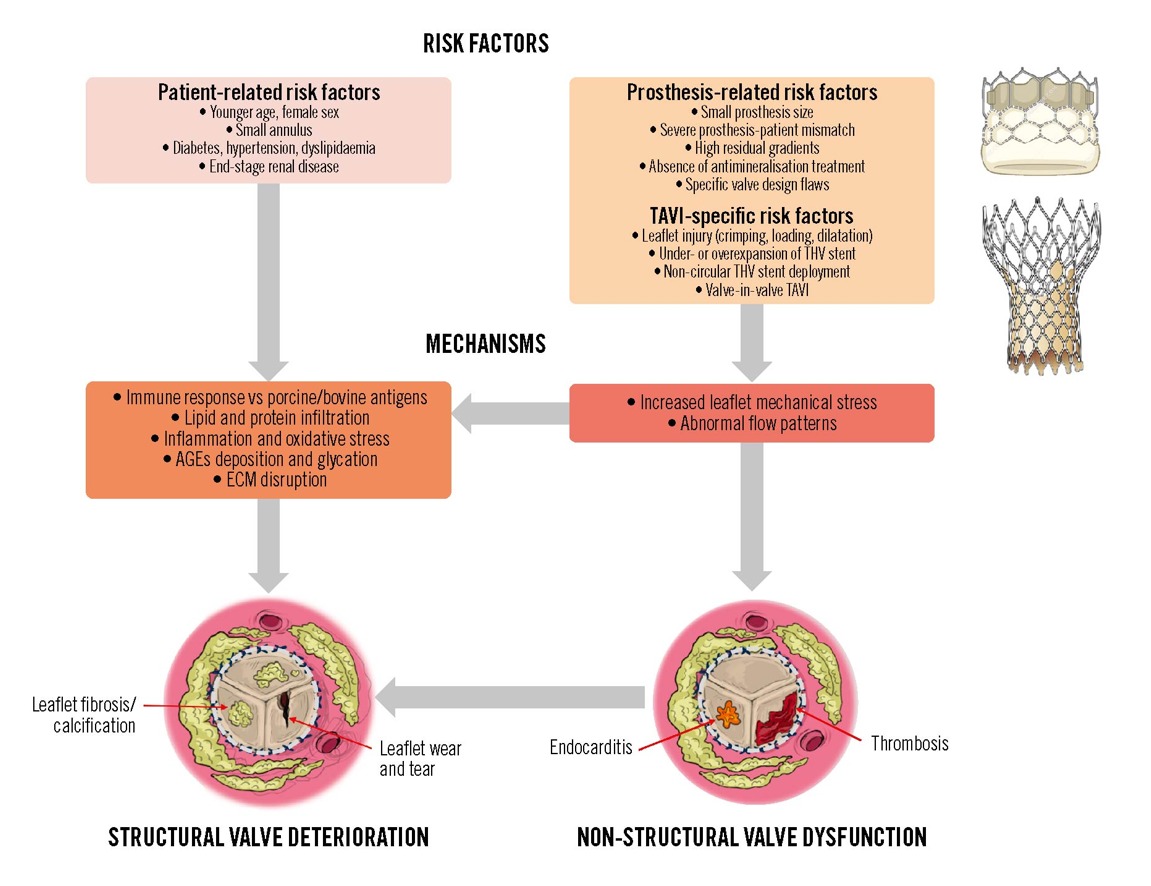
Entre los factores asociados a la SVD, se encuentran factores asociados al paciente, factores asociados a la prótesis y factores relacionados a el procedimiento. 5 (Figura 2)
Figura 2. Factores de riesgo y mecanismos de degeneración y falla estructural de la bioprótesis valvular.
AGEs: productos finales de glicación avanzada; ECM: matriz extracelular; TAVI: implante valvular aórtico transcatéter; THV: válvula cardíaca transcatéter. Reproducido y autorizado de Ternacle et al.5.
Mecanismos de degeneración valvular:
- Deterioro valvular estructural: De forma resumida, el SVD resulta de mecanismos complejos y multifactoriales. Entre sus principales causas se incluyen el estrés mecánico repetitivo sobre las valvas, los mecanismos pasivos de calcificación relacionados con el proceso de fijación de los tejidos bioprotésicos, así como mecanismos activos de tipo inmunológico e inflamatorio (Figura 3)6,7. Asimismo, el análisis macroscópico de bioprótesis explantadas ha demostrado que la calcificación y las roturas de valvas son procesos interrelacionados que contribuyen activamente a la disfunción valvular. 8
Figura 3. Mecanismos hipotéticos que conducen a la degeneración estructural valvular (SVD). IgG: inmunoglobulina G; LDL: lipoproteínas de baja densidad; Ox-LDL: lipoproteínas de baja densidad oxidadas. Reproducido con autorización de Pibarot et al.51
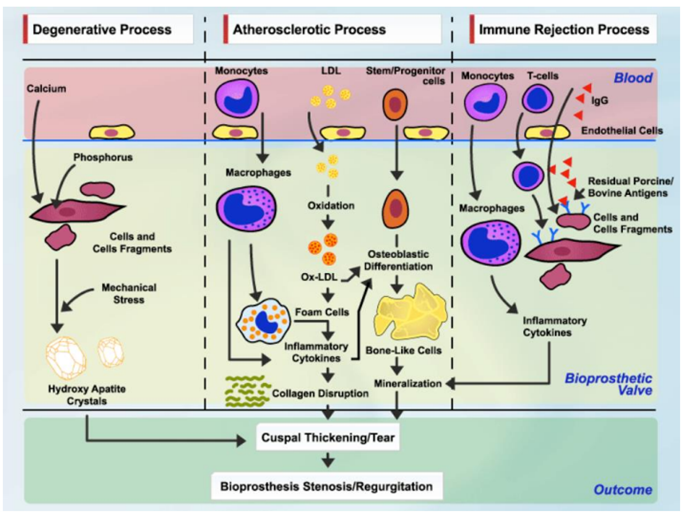
Los mecanismos involucrados son:
- Factores de riesgo cardiovasculares tradicionales como sexo femenino, hipertensión arterial, dislipemia, diabetes mellitus, fibrilación auricular, tabaquismo, insuficiencia renal crónica, hiperparatiroidismo, osteoporosis, gestación y pequeño tamaño del anillo valvular, como así el síndrome metabólico / obesidad con su eventual acumulación y oxidación de lipoproteínas están asociados a la progresión de la enfermedad, considerando a la estenosis aortica como una enfermedad similar a la aterosclerosis. 9-13 Cabe destacar que más del 40% de los pacientes que requieren intervención por estenosis aortica presentan estos factores de riesgo asociados, por lo cual el tratamiento de estas comorbilidades es clave para preservar la integridad de la válvula. Adicionalmente, si bien se consideran factores de riesgo para la progresión de la estenosis aortica, el tratamiento de estas comorbilidades no ha demostrado la disminución del riesgo de progresión de la estenosis 14,15.
- Asimismo, la disfunción del metabolismo fosfocálcico y niveles elevados de biomarcadores lipídicos —como los triglicéridos, el colesterol total, la relación apolipoproteína B/apolipoproteína A, la fosfolipasa A2 asociada a lipoproteínas (Lp-PLA2) y la convertasa proproteína subtilisina/kexina tipo 9 (PCSK9)— también se han asociado con una mayor incidencia de SVD.16-18
- Bases de glutaraldehido, las cuales son utilizadas para una mejor conservación de la prótesis hasta su implante. Estas bases enmascaran el antígeno y reducen el rechazo inmune, sin embargo, facilitan la fijación de iones de calcio de fosfolípidos circulantes lo cual lleva a calcificación e incremento de la rigidez de los leaflets 19.
- Disfunción endotelial la cual conlleva a un incremento en la adhesión leucocitaria, con un incremento en el tejido valvar a células pro inflamatorias como macrófagos, monocitos y linfocitos T.20. Estas células generan un estado pro inflamatorio, con eventual estimulación de células dendríticas y osteoblastos, favoreciendo la calcificación de la válvula protésica.21,22
2- Deterioro valvular no estructural:
- 2.1 El mismatch prótesis-paciente (PPM): fue descrito por primera vez en 1978 por Rahimtoola, quien lo definió como la condición en la cual el área efectiva de la válvula protésica, una vez implantada, es menor que la de una válvula humana normal.23 Este concepto fue posteriormente refinado por Pibarot et al., quienes introdujeron el método del área efectiva del orificio indexada predicha (EOAi). El PPM se define mediante el EOAi, que se calcula dividiendo el EOA por el BSA del paciente (Tabla 1). El umbral EOAi para definir PPM es de ≤0,85 cm2/m2 y ≤0,65 cm2/m2 para PPM moderada y grave, respectivamente 4,24,25. Sin embargo, en pacientes obesos (índice de masa corporal ≥30 kg/m2), estos umbrales pueden sobrestimar la incidencia y gravedad de la PPM debido al fenómeno de sobreindexación. Así, las directrices del Valve Research Consortium-3 recomiendan valores umbral ajustados en pacientes obesos: ≤0,70 cm²/m² para PPM moderadas y ≤0,55 cm²/m² para PPM graves 4. Un valor de EOAi inferior a 0,85 cm²/m² indica la presencia de PPM. 26 Si bien existe evidencia consistente sobre el impacto clínico negativo del PPM severo tras el remplazo valvular aórtico quirúrgico (surgical aortic valve replacement - SAVR), la asociación entre el PPM y los desenlaces clínicos posteriores al implante valvular aórtico transcatéter (transcatheter aortic valve implantation - TAVI) sigue siendo menor y controvertida.27 Estudios recientes han informado que el PPM severo se asocia con una degeneración más acelerada de las bioprótesis aórticas, lo que podría contribuir a un mayor riesgo de mortalidad a largo plazo tras el reemplazo valvular aórtico con prótesis biológica (AVR) 27-30. Sin embargo, los datos disponibles sobre los desenlaces a largo plazo siguen siendo limitados. Por lo tanto, es importante prestar especial atención a la prevención de PPM graves en el momento del primer TAVI o SAVR, especialmente en presencia de factores de riesgo para PPM como el sexo femenino, un anillo pequeño, válvula en válvula en las bioprótesis fallidas pequeñas y un tamaño corporal grande31,32.
- 2.2 Leak paravalvular: La relevancia de esta complicación radica en que la presencia de un leak paravalvular moderado o severo después de la intervención está asociado a un incremento del 300% de la mortalidad a los 30 días y un incremento de 2.3 veces la mortalidad a la año.33 Afortunadamente, la incidencia del mismo ha disminuido con el incremento de la experiencia de los operadores, sobredimensionamiento del dispositivo así como las mejoras de los dispositivos de última generación, con una incidencia reportada menor.34,35 Dentro de los factores de riesgo asociados a un incremento del leak paravalvular se incluyen una severa calcificación del landing zone del dispositivo, particularmente si la calcificación se localiza en el tracto de salid del ventrículo izquierdo (LVOT - left ventricle outflow tract) especialmente en aquellos pacientes que presentan un volumen de calcio ≥ 1000 mm3.36,37 Otros factores asociados son la utilización de dispositivos sin pollera, un oversizing o sobredimensionamiento insuficiente del dispositivo y una angulación aortica severa en aquellos dispositivos auto expandibles.35,38.
3- Trombosis de la válvula protésica
La trombosis protésica sintomática o hemodinámicamente significativa es rara, con una incidencia menor al 1% de los pacientes TAVI 39,40. Las manifestaciones clínicas pueden incluir disnea o gradientes transvalvulares aumentados. Los trombos no son siempre visibles por ecocardiografía transesofágica. La trombosis subclínica (SLT- subclinical leaflet thrombosis) se define como a la presencia de reducción del movimiento del leaflet asociado a lesiones valvulares hipo atenuadas en la tomografía computada multicorte.4 Este engrosamiento se define en la bibliografía como engrosamiento valvar hipo atenuado (hypoattenuating leaflet thickening [HALT]), el cual puede llevar a una disminución de la motilidad valvar (hypoattenuation affecting motion [HAM]) 41. La incidencia de la trombosis subclínica de las valvas (SLT, por sus siglas en inglés) puede variar desde un 10 al 20% en pacientes post TAVI y del 5 a 15% post SAVR 42; siendo significativamente menos frecuente en aquellos pacientes recibiendo anticoagulantes comparado con pacientes sin anticoagulación oral (4% vs 15%), p<0.05). No hubo diferencia entre pacientes recibiendo anticoagulantes directos vs warfarina (3 y 4%). Habitualmente, la mayoría de las trombosis se resuelve con un tratamiento anticoagulante óptimo. Sin embargo, es un proceso dinámico que puede revertirse espontáneamente sin tratamiento en hasta el 50% de los casos. Esta complicación podría desencadenar inflamación del tejido de las valvas y, posteriormente, conducir a fibrosis de las valvas y luego a calcificación.43,44 Si bien la trombosis valvular está asociada a un incremento en el riesgo de ataques isquémicos transitorios (4.18 vs 0.6 cada 100 personas año) a un mayor riesgo de accidente cerebrovascular [razón de riesgo global en metanálisis: 3,17; IC 95%: 1,30–7,72], no se ha demostrado una asociación con un aumento de la mortalidad. 42,45.
4- Endocarditis infecciosa (EI)
Todos los pacientes con válvulas protésicas, incluidas las TAVI, están considerados como pacientes de alto riesgo para endocarditis, por lo cual es mandatorio indicar profilaxis bacteriana para procedimientos de alto riesgo.
Por definición, se considera EI a aquella que sucede dentro de los 60 días, intermedia (entre los 60 y 365 días) y tarida a aquella posterior a los 365 días 46. La incidencia de endocarditis temprana presenta un rango de 0.3 a 3.4% por paciente año 46-49
Las complicaciones de la EI incluyen la invasión paravalvular (es decir de la raíz aortica o absceso paravalvular), eventos embólicos, estenosis valvular e insuficiencia valvular o paravalvular 46,47. La presencia de insuficiencia cardiaca clínica es frecuente, con una incidencia del 30%, así como también la afección de la válvula mitral por el intimo contacto con la fibrosa mitro aortica. La mortalidad de la endocarditis infecciosa es muy alta (siendo del 47.2%). Los microorganismos más frecuentemente asociados son los estafilococos coagulasa negativos (24%), seguidos por el estafilococo aureus (21%) y enterococos (21%)49. El algoritmo de tratamiento en pacientes post TAVI presenta similitud con aquel de la endocarditis asociada a prótesis valvulares quirúrgicas, es decir, recomendando cirugía en pacientes con signos y síntomas de insuficiencia cardiaca producto de deterioro valvular, fistula intracardiaca; bloqueo AV completo, abscesos aórticos o anulares, infección fúngica u otro microorganismo altamente resistente, o bacteriemia persistente a pesar de tratamiento antibiótico optimo por 5 a 7 días 50.
Abreviaciones
- AVR = Reemplazo valvular aórtico con prótesis biológica
- BSA = Superficie corporal del paciente
- BVD= Disfunción valvular bioprotésica
- BVF= Falla valvular bioprotésica
- EAPCI/EACTS = European Association for Cardio-Thoracic Surgery
- DVI= (Doppler velocity index) - índice de velocidad Doppler
- EOA= Area efectiva del orificio valvular
- EI= Endocarditis infecciosa
- GM = Gradiente medio
- HVD= Deterioro hemodinámico valvular
- IMC= índice de masa corporal
- NSVD = (Non-structural valve deterioration), Deterioro valvular no estructural
- PPM = Mismatch prótesis-paciente
- SVD = (Structural valve deterioration) – Deterioro valvular estructural
- SAVR = (Surgical aortic valve replacement) remplazo valvular aortico quirurgico
- TAVI = (Transcatheter aortic valve implantation) implante valvular aórtico transcatéter
- VARC-3 = Valve Academic Research Consortium 3
Bibliografía
- Dvir D, Bourguignon T, Otto CM, Hahn RT, Rosenhek R, Webb JG, Treede H, Sarano ME, Feldman T, Wijeysundera HC, et al. Standardized definition of structural valve degeneration for surgical and transcatheter bioprosthetic aortic valves. Circulation. 2018;137:388-399. doi: 10.1161/circulationaha.117.030729
- Pibarot P, Herrmann HC, Wu C, Hahn RT, Otto CM, Abbas AE, Chambers J, Dweck MR, Leipsic JA, Simonato M, et al. Standardized definitions for bioprosthetic valve dysfunction following aortic or mitral valve replacement: JACC state-of-the-art review. J Am Coll Cardiol. 2022;80:545-561. doi: 10.1016/j.jacc.2022.06.002
- Capodanno D, Petronio AS, Prendergast B, Eltchaninoff H, Vahanian A, Modine T, Lancellotti P, Søndergaard L, Ludman PF, Tamburino C, et al. Standardized definitions of structural deterioration and valve failure in assessing long-term durability of transcatheter and surgical aortic bioprosthetic valves: a consensus statement from the European Association of Percutaneous Cardiovascular Interventions(EAPCI) endorsed by the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2017;38:3382-3390. doi: 10.1093/eurheartj/ehx303
- Généreux P, Piazza N, Alu MC, Nazif T, Hahn RT, Pibarot P, Bax JJ, Leipsic JA, Blanke P, Blackstone EH, et al. Valve Academic Research Consortium 3: updated endpoint definitions for aortic valve clinical research. Eur Heart J. 2021;42:1825-1857. doi: 10.1093/eurheartj/ehaa799
- Ternacle J, Hecht S, Eltchaninoff H, Salaun E, Clavel M-A, Côté N, Pibarot P. Durability of transcatheter aortic valve implantation. EuroIntervention. 2024;20:e845-e864.
- Sénage T, Le Tourneau T, Foucher Y, Pattier S, Cueff C, Michel M, Serfaty JM, Mugniot A, Périgaud C, Carton HF, et al. Early structural valve deterioration of Mitroflow aortic bioprosthesis: mode, incidence, and impact on outcome in a large cohort of patients. Circulation. 2014;130:2012-2020. doi: 10.1161/circulationaha.114.010400
- Senage T, Paul A, Le Tourneau T, Fellah-Hebia I, Vadori M, Bashir S, Galiñanes M, Bottio T, Gerosa G, Evangelista A, et al. The role of antibody responses against glycans in bioprosthetic heart valve calcification and deterioration. Nat Med. 2022;28:283-294. doi: 10.1038/s41591-022-01682-w
- Bottio T, Thiene G, Pettenazzo E, Ius P, Bortolotti U, Rizzoli G, Valfre C, Casarotto D, Valente M. Hancock II bioprosthesis: a glance at the microscope in mid-long-term explants. J Thorac Cardiovasc Surg. 2003;126:99-105.
- Rodriguez-Gabella T, Voisine P, Puri R, Pibarot P, Rodés-Cabau J. Aortic bioprosthetic valve durability incidence, mechanisms, predictors, and management of surgical and transcatheter valve degeneration. J Am Coll Cardio. 2017;70:1013-1028. doi: 10.1016/j.jacc.2017.07.715
- Capoulade R, Clavel MA, Dumesnil JG, Chan KL, Teo KK, Tam JW, Côté N, Mathieu P, Després JP, Pibarot P. Impact of metabolic syndrome on progression of aortic stenosis: Influence of age and statin therapy. J Am Coll Cardiol. 2012;60:216-223.
- Capoulade R, Clavel MA, Mathieu P, Côté N, Dumesnil JG, Arsenault M, Bédard E, Pibarot P. Impact of hypertension and renin-angiotensin system inhibitors in aortic stenosis. Eur J Clin Invest. 2013;43:1262-1272.
- Cowell SJ, Newby DE, Prescott RJ, Bloomfield P, Reid J, Northridge DB, Boon NA. A randomized trial of intensive lipid-lowering therapy in calcific aortic stenosis. N Engl J Med. 2005;352:2389-2397.
- Freeman RV, Otto CM. Spectrum of calcific aortic valve disease: pathogenesis, disease progression, and treatment strategies. Circulation. 2005;111:3316-3326.
- Chan KL, Teo K, Dumesnil JG, Ni A, Tam J. Effect of lipid lowering with rosuvastatin on progression of aortic stenosis. Results of the aortic stenosis progression observation: Measuring effects of rosuvastatin (ASTRONOMER) trial. Circulation. 2010;121:306-314.
- Rossebo AB, Pedersen TR, Boman K, Brudi P, Chambers JB, Egstrup K, Gerdts E, Gohlke-Barwolf C, Holme I, Kesaniemi YA, et al. Intensive lipid lowering with simvastatin and ezetimibe in aortic stenosis. N Engl J Med. 2008;359:1343-1356.
- Mahjoub H, Mathieu P, Sénéchal M, Larose É, Dumesnil JG, Després JP, Pibarot P. ApoB/ApoA-I ratio is associated with increased risk of bioprosthetic valve degeneration. J Am Coll Cardiol. 2013;61:752-761.
- Nsaibia MJ, Mahmut A, Mahjoub H, Dahou A, Bouchareb R, Boulanger MC, Després JP, Bossé Y, Arsenault BJ, Larose É, et al. Association between plasma lipoprotein levels and bioprosthetic valve structural degeneration. Heart. 2016;102:1915-1921. doi: 10.1136/heartjnl-2016-309541
- Salaun E, Côté N, Clavel MA, Pibarot P. Biomarkers of aortic bioprosthetic valve structural degeneration. Curr Opin Cardiol. 2019;34:132-139. doi: 10.1097/hco.0000000000000590
- Chen W, Schoen FJ, Levy RJ. Mechanism of efficacy of 2-Amino oleic acid for inhibition of calcification of glutaraldehyde-pretreated porcine bioprosthetic heart valves. Circulation. 1994;90:323-329.
- Dweck MR, Boon NA, Newby DE. Calcific aortic stenosis: A disease of the valve and the myocardium. J Am Coll Cardiol. 2012;60:1854-1863.
- Menon V, Lincoln J. The genetic regulation of aortic valve development and calcific disease. Frontiers in cardiovascular medicine. 2018;5:162.
- Shetty R, Pibarot P, Audet A, Janvier R, Dagenais F, Perron J, Couture C, Voisine P, Després JP, Mathieu P. Lipid-mediated inflammation and degeneration of bioprosthetic heart valves. Eur J Clin Invest. 2009;39:471-480.
- Rahimtoola SH. The problem of valve prosthesis-patient mismatch. Circulation. 1978;58:20-24.
- Lancellotti P, Pibarot P, Chambers J, Edvardsen T, Delgado V, Dulgheru R, Pepi M, Cosyns B, Dweck M, Garbi M, et al. Recommendations for the imaging assessment of prosthetic heart valves: A report from the European Association of Cardiovascular Imaging endorsed by the Chinese Society of Echocardiography, the Interamerican Society of Echocardiography and the Brazilian Department of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2016;17:589-590. doi: doi:10.1093/ehjci/jew025
- Zoghbi WA, Chambers JB, Dumesnil JG, Foster E, Gottdiener JS, Grayburn PA, Khandheria BK, Levine RA, Marx GR, Miller FA, Jr., et al. Recommendations for evaluation of prosthetic valves with echocardiography and Doppler ultrasound: a report from the American Society of Echocardiography's Guidelines and Standards Committee and the Task Force on Prosthetic Valves, developed in conjunction with the American College of Cardiology Cardiovascular Imaging Committee, Cardiac Imaging Committee of the American Heart Association, the European Association of Echocardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography and the Canadian Society of Echocardiography, endorsed by the American College of Cardiology Foundation, American Heart Association, European Association of Echocardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography, and Canadian Society of Echocardiography. J Am Soc Echocardiogr. 2009;22:975-1014.
- Pibarot P, Dumesnil JG. Hemodynamic and clinical impact of prosthesis-patient mismatch in the aortic valve position and its prevention. J Am Coll Cardiol. 2000;36:1131-1141.
- Giuliani C, Zanuttini A, Hecht S, Ternacle J, Pibarot P. Prosthesis-Patient Mismatch: Current State of Evidence. Current Cardiology Reports. 2025;27:49.
- Urso S, Calderon P, Sadaba R, Mahillo I, Tunon J, Aldamiz G, Fraile J. Patient-prosthesis mismatch in patients undergoing bioprosthetic aortic valve implantation increases risk of reoperation for structural valve deterioration. J Card Surg. 2014;29:439-444.
- Mahjoub H, Mathieu P, Larose E, Dahou A, Senechal M, Dumesnil JG, Despres JP, Pibarot P. Determinants of aortic bioprosthetic valve calcification assessed by multidetector CT. Heart. 2015. doi: 10.1136/heartjnl-2014-306445
- Flameng W, Rega F, Vercalsteren M, Herijgers P, Meuris B. Antimineralization treatment and patient-prosthesis mismatch are major determinants of the onset and incidence of structural valve degeneration in bioprosthetic heart valves. J Thorac Cardiovasc Surg. 2014;147:1219-1224. doi: 10.1016/j.jtcvs.2013.03.025
- Leone PP, Regazzoli D, Pagnesi M, Sanz-Sanchez J, Chiarito M, Cannata F, Van Mieghem NM, Barbanti M, Tamburino C, Teles R, et al. Predictors and clinical impact of prosthesis-patient mismatch after self-expandable TAVR in small annuli. JACC Cardiovasc Interv. 2021;14:1218-1228. doi: 10.1016/j.jcin.2021.03.060
- Ternacle J, Al-Azizi K, Szerlip M, Potluri S, Hamandi M, Blanke P, Leipsic J, Dahou A, Salaun E, Vincent F, et al. Impact of predilation during transcatheter aortic valve replacement: insights from the PARTNER 3 trial. Circ Cardiovasc Interv. 2021;14:e010336. doi: 10.1161/circinterventions.120.010336
- Athappan G, Patvardhan E, Tuzcu EM, Svensson LG, Lemos PA, Fraccaro C, Tarantini G, Sinning JM, Nickenig G, Capodanno D, et al. Incidence, predictors, and outcomes of aortic regurgitation after transcatheter aortic valve replacement: meta-analysis and systematic review of literature. J Am Coll Cardiol. 2013;61:1585-1595.
- Forrest JK, Kaple RK, Tang GHL, Yakubov SJ, Nazif TM, Williams MR, Zhang A, Popma JJ, Reardon MJ. Three generations of self-expanding transcatheter aortic valves : A report from the STS/ACC TVT registry. JACC Cardiovasc Interv. 2020;13:170-179. doi: 10.1016/j.jcin.2019.08.035
- Mas-Peiro S, Alperi A, Regueiro A, Cruz Gonzalez I, Angellotti D, Campelo-Parada F, Urena M, Avanzas P, Vidal-Cales P, Barreira de Sousa GJ. Optimal Oversizing With the New-Generation Evolut (PRO/PRO+/FX) Self-Expanding Valves: A Multicenter Study. Circulation: Cardiovascular Interventions. 2024:e014916.
- Pollari F, Dell'Aquila AM, Söhn C, Marianowicz J, Wiehofsky P, Schwab J, Pauschinger M, Hitzl W, Fischlein T, Pfeiffer S. Risk factors for paravalvular leak after transcatheter aortic valve replacement. The Journal of thoracic and cardiovascular surgery. 2019;157:1406-1415. e1403.
- van Wely M, Rooijakkers M, Stens N, El Messaoudi S, Somers T, van Garsse L, Thijssen D, Nijveldt R, van Royen N. Paravalvular regurgitation after transcatheter aortic valve replacement: incidence, quantification, and prognostic impact. European Heart Journal-Imaging Methods and Practice. 2024;2:qyae040.
- Gorla R, De Marco F, Garatti A, Bianchi G, Popolo Rubbio A, Acerbi E, Casenghi M, Spagnolo P, Brambilla N, Testa L. Impact of aortic angle on transcatheter aortic valve implantation outcome with Evolut‐R, Portico, and Acurate‐NEO. Catheterization and Cardiovascular Interventions. 2021;97:E135-E145.
- Latib A, Naganuma T, Abdel-Wahab M, Danenberg H, Cota L, Barbanti M, Baumgartner H, Finkelstein A, Legrand V, de Lezo JS, et al. Treatment and clinical outcomes of transcatheter heart valve thrombosis. Circ Cardiovasc Interv. 2015;8:1-8.
- De Marchena E, Mesa J, Pomenti S, Marin y Kall C, Marincic X, Yahagi K, Ladich E, Kutz R, Aga Y, Ragosta M, et al. Thrombus formation following transcatheter aortic valve replacement. JACC Cardiovasc Interv. 2015;8:728-739.
- Sondergaard L, De Backer O, Kofoed KF, Jilaihawi H, Fuchs A, Chakravarty T, Kashif M, Kazuno Y, Kawamori H, Maeno Y, et al. Natural history of subclinical leaflet thrombosis affecting motion in bioprosthetic aortic valves. Eur Heart J. 2017;38:2201-2207. doi: 10.1093/eurheartj/ehx369
- Giuliani C, Zanuttini A, Salaun E, Côté N, Clavel MA, Pibarot P. Subclinical valve leaflet thrombosis following bioprosthetic aortic valve replacement. Current Opinion in Cardiology. 2024;39:457-464.
- Sellers SL, Turner CT, Sathananthan J, Cartlidge TRG, Sin F, Bouchareb R, Mooney J, Nørgaard BL, Bax JJ, Bernatchez PN, et al. Transcatheter aortic heart valves: histological analysis providing insight to leaflet thickening and structural valve degeneration. JACC Cardiovasc Imaging. 2019;12:135-145. doi: 10.1016/j.jcmg.2018.06.028
- Hein M, Schoechlin S, Schulz U, Minners J, Breitbart P, Lehane C, Neumann FJ, Ruile P. Long-term follow-up of hypoattenuated leaflet thickening after transcatheter aortic valve replacement. JACC Cardiovasc Interv. 2022;15:1113-1122. doi: 10.1016/j.jcin.2022.04.018
- Rheude T, Pellegrini C, Stortecky S, Marwan M, Xhepa E, Ammon F, Pilgrim T, Mayr NP, Husser O, Achenbach S, et al. Meta-analysis of bioprosthetic valve thrombosis after transcatheter aortic valve implantation. Am J Cardiol. 2021;138:92-99. doi: 10.1016/j.amjcard.2020.10.018
- Latib A, Naim C, De Bonis M, Sinning JM, Maisano F, Barbanti M, Parolari A, Lorusso R, Testa L, Actis Dato GM. TAVR-associated prosthetic valve infective endocarditis: results of a large, multicenter registry. Journal of the American College of Cardiology. 2014;64:2176-2178.
- Mylotte D, Andalib A, Theriault-Lauzier P, Dorfmeister M, Girgis M, Alharbi W, Chetrit M, Galatas C, Mamane S, Sebag I. Transcatheter heart valve failure: a systematic review. European heart journal. 2015;36:1306-1327.
- Sulženko J, Toušek P, Línková H. Infective endocarditis as a mid‐term complication after transcatheter aortic valve implantation: Case report and literature review. Catheterization and Cardiovascular Interventions. 2014;84:311-315.
- Amat-Santos IJ, Messika-Zeitoun D, Eltchaninoff H, Kapadia S, Lerakis S, Cheema A, Gutiérrez-Ibanes E, Munoz-Garcia A, Pan M, Webb JG, et al. Infective endocarditis following transcatheter aortic valve implantation: results from a large multicenter registry. Circulation. 2015;131:1566-1574.
- Baddour LM, Wilson WR, Bayer AS, Fowler Jr VG, Tleyjeh IM, Rybak MJ, Barsic B, Lockhart PB, Gewitz MH, Levison ME. Infective endocarditis in adults: diagnosis, antimicrobial therapy, and management of complications: a scientific statement for healthcare professionals from the American Heart Association. Circulation. 2015;132:1435-1486.
- Pibarot P, Dumesnil JG. Prosthetic heart valves: Selection of the optimal prosthesis and long-term management. Circulation. 2009;119:1034-1048.




